题目内容
现有锌粉和另一种金属组成的混合物,在6.5g该混合物中加入100g一定溶质质量分数的稀盐酸后,混合物与稀盐酸恰好完全反应,产生氢气的质量为m,下列说法正确的是
- A.若混合物为Zn,Mg,m可能是0.2g
- B.若混合物为Zn,Fe,m等于0.2g
- C.若混合物为Zn,Fe,m等于0.1g,混合物中铁的质量分数为50%
- D.若混合物为Zn,Mg,则稀盐酸中溶质质量分数一定大于7.3%.
D
分析:假设这6.5 g全部为锌,根据方程式计算出生成氢气为0.2g,所以剩余的金属中必须假设都是6.5g时产生氢气的质量必须有比0.2g大的,有比0.2g小的,然后结合结论“金属与酸反应时生成氢气的质量= ×金属的质量”再进行进一步分析即可.
×金属的质量”再进行进一步分析即可.
解答:假设6.5g全部为锌,设生成氢气质量为x则:
Zn+2Cl═ZnCl2+H2↑
65 2
6.5g x
 =
=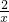
解得:x=0.2g
同理可计算出6.5g镁、铁与足量盐酸反应产生氢气的质量大于0.2g,
所以可以判断不论是锌中含有镁或是铁,最终生成的氢气的质量都必然大于0.2g,故A和B都是错误的;
C、若铁质量分数为50%,则锌的质量为3.25g,根据上述计算可以知道,3.25g锌能够生成氢气的质量为0.1g,同时铁也能够和稀盐酸反应,所以生成氢气的质量必然大于0.1g,故C错误;
D、从上述方程式中可以分析得出,6.5g锌消耗盐酸的质量为7.3g,即此时盐酸的浓度为7.3%,但是等质量的镁消耗盐酸的质量更多,所以若混合物为Zn,Mg,则稀盐酸中溶质质量分数一定大于7.3%,故D正确.
故选D.
点评:相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量和化合价有关.同价态的金属若相对原子质量越大,产生的氢气质量越小.
分析:假设这6.5 g全部为锌,根据方程式计算出生成氢气为0.2g,所以剩余的金属中必须假设都是6.5g时产生氢气的质量必须有比0.2g大的,有比0.2g小的,然后结合结论“金属与酸反应时生成氢气的质量=
 ×金属的质量”再进行进一步分析即可.
×金属的质量”再进行进一步分析即可.解答:假设6.5g全部为锌,设生成氢气质量为x则:
Zn+2Cl═ZnCl2+H2↑
65 2
6.5g x
 =
=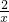
解得:x=0.2g
同理可计算出6.5g镁、铁与足量盐酸反应产生氢气的质量大于0.2g,
所以可以判断不论是锌中含有镁或是铁,最终生成的氢气的质量都必然大于0.2g,故A和B都是错误的;
C、若铁质量分数为50%,则锌的质量为3.25g,根据上述计算可以知道,3.25g锌能够生成氢气的质量为0.1g,同时铁也能够和稀盐酸反应,所以生成氢气的质量必然大于0.1g,故C错误;
D、从上述方程式中可以分析得出,6.5g锌消耗盐酸的质量为7.3g,即此时盐酸的浓度为7.3%,但是等质量的镁消耗盐酸的质量更多,所以若混合物为Zn,Mg,则稀盐酸中溶质质量分数一定大于7.3%,故D正确.
故选D.
点评:相同质量的金属与酸反应产生氢气的质量的多少与金属的相对原子质量和化合价有关.同价态的金属若相对原子质量越大,产生的氢气质量越小.

练习册系列答案
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
现有锌粉和另一种金属组成的混合物,在6.5g该混合物中加入100g一定溶质质量分数的稀盐酸后,混合物与稀盐酸恰好完全反应,产生氢气的质量为m,下列说法正确的是( )
|
| A. | 若混合物为Zn,Mg,m可能是0.2g |
|
| B. | 若混合物为Zn,Fe,m等于0.2g |
|
| C. | 若混合物为Zn,Fe,m等于0.1g,混合物中铁的质量分数为50% |
|
| D. | 若混合物为Zn,Mg,则稀盐酸中溶质质量分数一定大于7.3%. |