题目内容
某研究性学习小组的同学欲分离氯化钠和氯化钙的混合物,设计了如下实验操作:
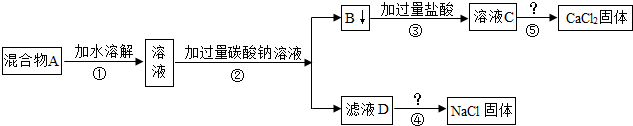
(1)②中发生反应的化学方程式为
(2)②中需要进行的操作是
(3)小组内的乙同学认为,上述所得的NaCl固体不纯,要得到较纯净的NaCl固体,需对实验进行改进,他的做法是

(1)②中发生反应的化学方程式为
Na2CO3+CaCl2=2NaCl+CaCO3↓
Na2CO3+CaCl2=2NaCl+CaCO3↓
.(2)②中需要进行的操作是
过滤
过滤
,操作⑤的名称是蒸发结晶
蒸发结晶
,两个操作中都需用到的玻璃仪器是玻璃棒
玻璃棒
.(3)小组内的乙同学认为,上述所得的NaCl固体不纯,要得到较纯净的NaCl固体,需对实验进行改进,他的做法是
在⑤中加入过量的稀盐酸
在⑤中加入过量的稀盐酸
.分析:(1)依据碳酸钠和氯化钙的反应原理书写方程式;
(2)②生成的沉淀和滤液分离,说明是用过滤的操作方法,⑤步是从溶液中提取溶质,故是蒸发结晶过程,操作中都需要玻璃棒;
(3)为充分把氯化钙反应掉,加入过量的碳酸钠溶液,故得到的氯化钠固体不纯,可加入过量盐酸除掉溶液中过量的碳酸钠溶液.
(2)②生成的沉淀和滤液分离,说明是用过滤的操作方法,⑤步是从溶液中提取溶质,故是蒸发结晶过程,操作中都需要玻璃棒;
(3)为充分把氯化钙反应掉,加入过量的碳酸钠溶液,故得到的氯化钠固体不纯,可加入过量盐酸除掉溶液中过量的碳酸钠溶液.
解答:解:(1)碳酸钠溶液和氯化钙溶液反应生成碳酸钙沉淀和氯化钠,方程式是:Na2CO3+CaCl2=2NaCl+CaCO3↓;
(2)②生成的沉淀和滤液分离,而过滤可将可溶性物质和不溶性物质分离,因此是用过滤的操作方法,⑤步是从溶液中提取溶质,故是蒸发结晶过程,操作中都需要玻璃棒;
(3)为充分把氯化钙反应掉,加入过量的碳酸钠溶液,故得到的氯化钠固体不纯,加入过量盐酸是为了除掉溶液中过量的碳酸钠溶液,让上一步加入的过量碳酸钠完全转化为氯化钠;
故答案为:(1)Na2CO3+CaCl2=2NaCl+CaCO3↓;
(2)过滤;蒸发结晶;玻璃棒;
(3)在⑤中加入过量的稀盐酸.
(2)②生成的沉淀和滤液分离,而过滤可将可溶性物质和不溶性物质分离,因此是用过滤的操作方法,⑤步是从溶液中提取溶质,故是蒸发结晶过程,操作中都需要玻璃棒;
(3)为充分把氯化钙反应掉,加入过量的碳酸钠溶液,故得到的氯化钠固体不纯,加入过量盐酸是为了除掉溶液中过量的碳酸钠溶液,让上一步加入的过量碳酸钠完全转化为氯化钠;
故答案为:(1)Na2CO3+CaCl2=2NaCl+CaCO3↓;
(2)过滤;蒸发结晶;玻璃棒;
(3)在⑤中加入过量的稀盐酸.
点评:解决混合物的分离首先应考虑物理方法比如过滤操作,不可取再考虑化学转化的方式进行,熟悉物质的化学性质,明确过程中的各种产物,并结合题意细致分析是解答的关键.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案
相关题目
(2009?天河区一模)某研究性学习小组的学生在学习完分子的特征后,做了如下两个实验,请按要求填空:
| 实验步骤 | 实验现象 | 实验结论或解释 |
| 实验一:在两个相同的茶杯内分别注入同体积的凉开水,一只杯子里加一小匙蜂蜜(主要成分是果糖),另一只杯子里加一小匙白醋(主要成分是醋酸),立即尝两只杯子里的水. | 放蜂蜜的杯子里的水基本不甜,放白醋的杯子里的水很酸. | ______分子的运动的速度比______分子的运动速度快,这说明相对分子质量越小的物质其分子的运动速度就______.(填“快”或“慢”)(提示:醋酸分子的相对分子质量比果糖分子的相对分子质量小.) |
实验二:如图所示的玻璃管两端甲、乙两处分别放着蘸有浓氨水和浓盐酸的棉花. | 在______处出现较多白烟(填A或B或C). | 浓氨水挥发出来的氨分子(NH3)和浓盐酸挥发出来的氯化氢分子(HCl )接触时会产生大量的白烟. |
25.(2009?天河区一模)某研究性学习小组的学生在学习完分子的特征后,做了如下两个实验,请按要求填空:
| 实验步骤 | 实验现象 | 实验结论或解释 |
| 实验一:在两个相同的茶杯内分别注入同体积的凉开水,一只杯子里加一小匙蜂蜜(主要成分是果糖),另一只杯子里加一小匙白醋(主要成分是醋酸),立即尝两只杯子里的水. | 放蜂蜜的杯子里的水基本不甜,放白醋的杯子里的水很酸. | ______分子的运动的速度比______分子的运动速度快,这说明相对分子质量越小的物质其分子的运动速度就______.(填“快”或“慢”)(提示:醋酸分子的相对分子质量比果糖分子的相对分子质量小.) |
实验二:如图所示的玻璃管两端甲、乙两处分别放着蘸有浓氨水和浓盐酸的棉花. | 在______处出现较多白烟(填A或B或C). | 浓氨水挥发出来的氨分子(NH3)和浓盐酸挥发出来的氯化氢分子(HCl )接触时会产生大量的白烟. |