题目内容
电解水时,常在水中加入硫酸钠使反应容易进行,硫酸钠本身并不被分解.现用45g含有硫酸钠的水进行电解水实验,一段时间后,称量剩余液体的质量36克.计算:
(1)水中氢、氧两种元素的质量比为 .
(2)水中氧元素的质量分数为 (结果保留小数后1位).
(3)求上述电解水实验中可生成了多少克的氧气?
(1)水中氢、氧两种元素的质量比为
(2)水中氧元素的质量分数为
(3)求上述电解水实验中可生成了多少克的氧气?
考点:根据化学反应方程式的计算,元素质量比的计算,元素的质量分数计算
专题:化学式的计算,有关化学方程式的计算
分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答;
(2)根据物质的化学式可以计算物质中元素的质量比、元素的质量分数;
(3)根据电解水的实验可知,水分解生成氢气和氧气,则含有硫酸钠的水进行电解水实验,可利用硫酸的质量不变,减少的质量为被点解的水的质量,依据电解水的质量根据方程式可计算生成氢气的质量;
(2)根据物质的化学式可以计算物质中元素的质量比、元素的质量分数;
(3)根据电解水的实验可知,水分解生成氢气和氧气,则含有硫酸钠的水进行电解水实验,可利用硫酸的质量不变,减少的质量为被点解的水的质量,依据电解水的质量根据方程式可计算生成氢气的质量;
解答:解:
(1)水的化学式为H2O,根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得水中氢、氧元素的质量比为(1×2):(16×1)=1:8;
(2)水中氧元素的质量分数为:
×100%≈89%;
(3)被电解的水的质量为45g-36g=9g
设电解产生氧气的质量为x
2H2O
2H2↑+O2↑
36 32
9g x
=
x=8g
答案:
(1)1:8;
(2)89%
(3)电解水实验中可生成氧气的质量为8g.
(1)水的化学式为H2O,根据化合物中各元素质量比=各元素的相对原子质量×原子个数之比,可得水中氢、氧元素的质量比为(1×2):(16×1)=1:8;
(2)水中氧元素的质量分数为:
| 16 |
| 18 |
(3)被电解的水的质量为45g-36g=9g
设电解产生氧气的质量为x
2H2O
| ||
36 32
9g x
| 36 |
| 32 |
| 9g |
| x |
x=8g
答案:
(1)1:8;
(2)89%
(3)电解水实验中可生成氧气的质量为8g.
点评:本题难度不大,考查同学们灵活运用化学式的有关计算进行分析问题、解决问题的能力.考查以电解水的实验来进行的简单计算,学生明确电解中硫酸的质量不变是解答本题的关键.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
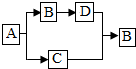 下列物质A、B、C、D都是初中化学中的常见物质,它们之间具有如图所示的转化关系(反应条件、有些反应物或产物已略去).其中A与B的组成元素相同,C可使带火星的木条复燃,D是一种无色气体单质.
下列物质A、B、C、D都是初中化学中的常见物质,它们之间具有如图所示的转化关系(反应条件、有些反应物或产物已略去).其中A与B的组成元素相同,C可使带火星的木条复燃,D是一种无色气体单质.
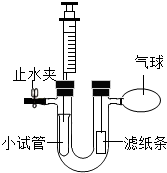 如图所示装置的U形管左侧管内固定一小试管.
如图所示装置的U形管左侧管内固定一小试管.