题目内容
【题目】(12分)2015年3月22日是第二十三届“世界水日”,主题是“水与可持续发展”。
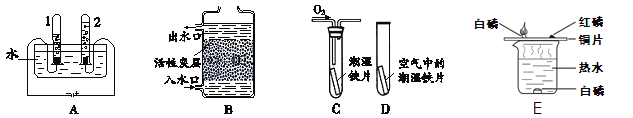
(1)根据下图回答问题。
①A图所示的是水的电解实验,试管2中收集的气体是 (填名称)。
②B图所示的是活性炭净水器的示意图,其中活性炭的作用是 。
③C、D图所示的是探究铁生锈条件的实验,一段时间后发现C中铁片变红,D中铁片依然光亮,对比C、D中的现象,说明决定铁生锈快慢的一个重要因素是: 。
④E图所示的是探究燃烧条件实验,其中热水作用 。
(2)若用质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3)配制110g质量分数为5%的氢氧化钠溶液。
①计算:需10%的氢氧化钠溶液体积为 mL。
②量取:用量筒量取氢氧化钠溶液和水,均倒入烧杯中。若量取氢氧化钠溶液读数时俯视,而其余操作均正确,这样配得的溶液的溶质质量分数会 (填“偏高”、“偏低”或“无影响”);用量筒量取水。
③混匀:用玻璃棒搅拌,使氢氧化钠溶液和水混合均匀。
④装瓶并贴上标签。
(3)某化学兴趣小组为了测定某工厂废水中硫酸的质量分数,取100g废水于烧杯中,加入上述配制好的氢氧化钠溶液80g,恰好完全反应(废水中无不溶物,其它成份不与氢氧化钠反应)。请计算废水中硫酸的质量分数。(写出计算过程)
【答案】(1)①氧气 ②滤去其中不溶性的物质,还可以吸附色素和异味 ③氧气的浓度
④升温,使温度达到白磷的着火点,且使水中的白磷与空气隔绝(其他合理的答案也给分)
(2)①50 ②偏低
【解析】
试题分析:(1)电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ,试管2与试管1的气体体积比为1:2,故试管2中生成的是氧气;
活性炭具有疏松多孔的结构,能吸附色素和异味,具有吸附性;
铁生锈的条件是与水氧气同时接触,试管C和试管D中条件的区别是氧气的浓度不同,根据实验现象可知,氧气的浓度越高,越容易生锈;
燃烧需要同时满足三个条件:一是要有可燃物,二是可燃物要与氧气接触,三是温度要达到可燃物的着火点;以上三个条件都能满足时,可燃物才能发生燃烧。其中热水提供的是热量,使铜片上的白磷达到着火点,同时也使水中的白磷与空气隔绝;
(2)溶液稀释的构成中溶质的质量不变,设需要10%的氢氧化钠溶液的质量为x,10%x=110g×5%,x=55g,它的体积=55g÷1.1g/cm3=50ml;量筒读数的方法是视线要与凹液面的最低处保持水平,仰视读数偏小,俯视读数偏大。若量取氢氧化钠溶液读数时俯视,那么实际所得氢氧化钠溶液的体积偏小,即溶质的质量偏小,那么这样配得的溶液的溶质质量分数会偏低;
(3)利用化学方程式,根据反应的质量比即可计算出硫酸中溶质的质量。
解:设废水中硫酸的质量为x
2NaOH + H2SO4 = Na2SO4 + 2H2O
80 98
80g×5% x
![]()
x=4.9g
![]()
答:废水中硫酸的质量分数4.9%