题目内容
食醋、食盐和纯碱都是日常生活中常用的物质.食醋中通常含有3%~5%的乙酸,乙酸俗称醋酸,是一种无色液体.食盐和纯碱都是白色固体.
(1)在用食醋拌凉菜时,往往可以闻到醋香,这说明醋酸具有 性.食醋不宜存放在含铁等金属的容器内,原因是 .
(2)用食醋可以鉴别食盐和纯碱.请简要写出实验步骤和现象: .
(3)纯碱的水溶液能使紫色石蕊溶液变蓝,说明其水溶液显 性,而在酸、碱、盐三类化合物中,纯碱属于 类.纯碱还能与许多化合物反应,请写一个你知道的纯碱与碱反应的化学方程式 .
(1)在用食醋拌凉菜时,往往可以闻到醋香,这说明醋酸具有
(2)用食醋可以鉴别食盐和纯碱.请简要写出实验步骤和现象:
(3)纯碱的水溶液能使紫色石蕊溶液变蓝,说明其水溶液显
考点:醋酸的性质及醋酸的含量测定,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:常见的酸 酸的通性,常见的盐 化学肥料
分析:(1)醋酸属于酸,结合酸的化学性质(能与活泼金属、金属氧化物、碱、碳酸盐等反应),进行分析解答.
(2)食盐主要成分是氯化钠,纯碱主要成分是碳酸钠,醋酸可以与碳酸钠反应生成气体,据此进行分析解答.
(3)紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝;纯碱是由钠离子和碳酸根离子构成的化合物;纯碱能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,写出反应的化学方程式即可.
(2)食盐主要成分是氯化钠,纯碱主要成分是碳酸钠,醋酸可以与碳酸钠反应生成气体,据此进行分析解答.
(3)紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝;纯碱是由钠离子和碳酸根离子构成的化合物;纯碱能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,写出反应的化学方程式即可.
解答:解:(1)在用食醋拌凉菜时,往往可以闻到醋香,这说明醋酸具有酸性;食醋不宜存放在含铁等金属的容器内,是由铝的金属活动性比氢强,铝能与醋酸发生置换反应生成醋酸铝.
(2)食盐主要成分是氯化钠,纯碱主要成分是碳酸钠,醋酸可以与碳酸钠反应生成气体,不能与氯化钠反应,可用食醋鉴别食盐和纯碱;分别取两种待测物质各少许,分别滴加食醋,产生气泡的是纯碱,无明显变化的是食盐.
(3)紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝,纯碱的水溶液能使紫色石蕊溶液变蓝,说明其水溶液显碱性;而在酸、碱、盐三类化合物中,纯碱是由钠离子和碳酸根离子构成的化合物,属于盐;纯碱能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(合理即可).
故答案为:(1)酸;铝的金属活动性比氢强,铝能与醋酸发生置换反应;(2)分别取两种待测物质各少许,分别滴加食醋,产生气泡的是纯碱,无明显变化的是食盐;(3)碱;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
(2)食盐主要成分是氯化钠,纯碱主要成分是碳酸钠,醋酸可以与碳酸钠反应生成气体,不能与氯化钠反应,可用食醋鉴别食盐和纯碱;分别取两种待测物质各少许,分别滴加食醋,产生气泡的是纯碱,无明显变化的是食盐.
(3)紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝,纯碱的水溶液能使紫色石蕊溶液变蓝,说明其水溶液显碱性;而在酸、碱、盐三类化合物中,纯碱是由钠离子和碳酸根离子构成的化合物,属于盐;纯碱能与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(合理即可).
故答案为:(1)酸;铝的金属活动性比氢强,铝能与醋酸发生置换反应;(2)分别取两种待测物质各少许,分别滴加食醋,产生气泡的是纯碱,无明显变化的是食盐;(3)碱;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH.
点评:本题难度不大,掌握酸的化学性质、盐的化学性质、酸碱盐的特征、化学方程式的书写方法等是正确解答本题的关键.

练习册系列答案
相关题目
下列反应属于中和反应的是( )
| A、石灰水和盐酸 |
| B、硝酸银和盐酸 |
| C、纯碱和硫酸 |
| D、氯化钙和碳酸钠 |
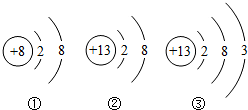 根据下列粒子的结构示意图,按要求填空:
根据下列粒子的结构示意图,按要求填空: