题目内容
【题目】a、b两种物质的溶解度曲线如图所示.下列叙述不正确的是( ) 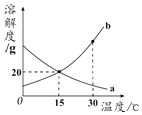
A.25℃时,b比a更易溶于水
B.30℃时,将a、b的饱和溶液分别降温至15℃,两溶液的溶质质量分数相等
C.30℃时,a的饱和溶液可以通过降温方法变为不饱和溶液
D.15℃时,b的饱和溶液中溶质与溶剂的质量比为1:5
【答案】B
【解析】解:A、25℃时,b的溶解度大于a的溶解度,即等质量的水中溶解的b的质量大于a,所以b比a更易溶于水,正确;B、30℃时将a、b的饱和溶液分别降温至15℃,a物质的溶解度增大,变为不饱和溶液,溶质的质量分数与降温前相等,而b的溶解度减小析出晶体,饱和时质量分数的计算式 ![]() ×100%,而降温后b的溶解度大于降温前a的溶解度,故溶质的质量分数b>a,故错误;
×100%,而降温后b的溶解度大于降温前a的溶解度,故溶质的质量分数b>a,故错误;
C、a的溶解度随着温度的降低而增大,所以30℃时a的饱和溶液可以通过降温方法变为不饱和溶液,正确;
D、15℃时,b的溶解度是20g,即100g水中最多溶解20g的b,所以饱和溶液中溶质与溶剂的质量比为20g:100g=1:5,正确;
故选:B.
【考点精析】掌握饱和溶液和不饱和溶液相互转变的方法和固体溶解度曲线及其作用是解答本题的根本,需要知道饱和和不饱和的转变方法:①Ca(OH)2和气体等除外,它的溶解度随温度升高而降低②最可靠的方法是:加溶质、蒸发溶剂;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

练习册系列答案
相关题目





