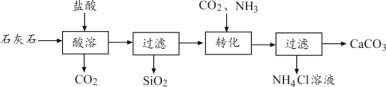
题目内容
【题目】某化学兴趣小组为测定某石灰石样品中碳酸钙的质量分数,取2.6g石灰石样品放在烧杯中,然后向其中逐渐加入稀盐酸,使之与样品充分反应,恰好完全反应(杂质不参加反应)时,加入稀盐酸的质量为9.0g,反应后烧杯中物质的总质量为10.5g。请计算:
(1)反应生成二氧化碳的质量________。
(2)样品中碳酸钙的质量分数_________。(结果保留到0.1%)
【答案】1.1g 96.2%
【解析】
根据质量守恒定律可知,过程中质量的减少是因为生成了二氧化碳,所以可以求算二氧化碳的质量,根据二氧化碳的质量和对应的化学方程式求算碳酸钙的质量分数。
解:(1)根据质量守恒定律,二氧化碳的质量为:2.6g+9.0g-10.5g=1.1g;
(2)设该石灰石样品中碳酸钙的质量分数为x,
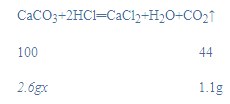
![]()
x=96.2%;
答:(1)反应生成二氧化碳的质量为1.1g;
(2)样品中碳酸钙的质量分数为96.2%。

练习册系列答案
相关题目
【题目】补齐连线。请从A或B两题中任选一个作答,若两题均作答,按A计分。
A 用途—性质 | B 事故—处理方法 | ||
氮气做保护气________ | 升华吸热 | 炒菜时油锅着火________ | 用液态二氧化碳灭火器扑灭 |
石墨用作电极材料________ | 化学性质稳定 | 厨房煤气管道漏气________ | 立即盖上锅盖 |
干冰可用于人工降雨________ | 导电性 | 图书馆内图书着火________ | 立即关闭阀门并开窗通风 |