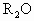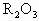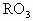题目内容
还原某金属R的氧化物2.32克,可得到金属1.68克.若已知金属R的相对原子质量为56,则此金属氧化物化学式为( )
| A、R2O3 | B、R3O4 | C、RO2 | D、RO |
分析:可设出金属氧化物的化学式,利用金属氧化物与氢气反应的化学反应方程式,将纯物质的量代入方程式来列式计算.
解答:解:设金属氧化物的化学式为RxOy,
已知2.32g金属氧化物、得到1.68g金属、金属的相对原子质量为56,
则:RxOy→xR,
56x+16y 56x
2.32g 1.68g
=
解得 x:y=3:4
即金属氧化物的化学式为R3O4,
故选B.
已知2.32g金属氧化物、得到1.68g金属、金属的相对原子质量为56,
则:RxOy→xR,
56x+16y 56x
2.32g 1.68g
| 56x+16y |
| 56x |
| 2.32g |
| 1.68g |
解得 x:y=3:4
即金属氧化物的化学式为R3O4,
故选B.
点评:本题考查学生利用化学反应方程式的计算来确定物质的化学式,在解答中可采用正向思维将氧化物的化学式当作已知来分析,学生应注意思维的顺序和格式的规范.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目