题目内容
7 分)(1)锌片长期暴露在空气中表面会形成一层薄膜,其主要成分是碱式碳酸锌【Zn2(OH)2CO3】。若该物质通过化合反应生成,反应物除 Zn 外,还有 ①N2 ②O2 ③CO2 ④H2O中的( )
| A.一种 | B.两种 | C.三种 | D.四种 |
①反应中产生的气体的质量是 g。
②计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。
③如果铁钉的铁锈未除净,对硫酸的质量分数的计算结果的影响是“偏大”“偏小”、 无影响”),理由是 。
(1)C(1分) (2)①0.1(1分)②32.7%;③偏小(1 分);硫酸与铁锈反应(1 分)
解析试题分析:(1)根据质量守恒定律反应前后原子的种类和数量不变,可知还要有,二氧化碳、水、氧气;
(2)根据质量守恒定律知:33.2g+10.8g-43.9g=0.1g
②解:硫酸废液的质量为33.2g—18.2g=15g(0.5分)
设样品中H2SO4的质量为x
Fe+ H2SO4=FeSO4+ H2↑(1分)
98 2
x 0.1g
x=4.9g(0.5分)
硫酸的质量分数为:4.9g/15g×100%≈32.7%(1分)
考点:质量守恒定律,根据化学方程式的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
九年级九班的小虎人称“小马虎”,下面是从他的笔记中摘录的部分化学用语,你认为正确的是( )
| A.2个氮原子:N2 |
| B.铝离子:Al+3 |
| C.2个氢分子:2H2 |
| D.硝酸铜:CuNO3 |
砷化镓(GaAs)是一种“LED”绿色节能光源材料,GaAs中As的化合价为-3,则Ga的化合价为
| A.-5 | B.-3 | C.+3 | D.+5 |
化学方程式书写正确的是
| A.Cu+FeSO4→Fe+ CuSO4 | B.Fe + H2SO4 → FeSO4 + H2↑ |
| C.Fe + 2AgCl→2Ag + FeCl2 | D.4Fe + 3 O2 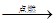 2Fe2O3 2Fe2O3 |
钛和钛合金被认为是21世纪的重要金属材料,它在元素周期表中的某些信息如下图所示。下列有关钛的说法正确的是
| A.属于非金属元素 | B.原子核内中子数为22 |
| C.相对原子质量为47.87g | D.原子核外有22个电子 |
绿茶中的单宁酸(C76H52O46)具有清热解毒的功效,下列说法不正确的是
| A.单宁酸由碳、氢、氧元素组成 |
| B.一个单宁酸分子中含52个氢原子 |
| C.单宁酸中碳、氢、氧元素的质量比为12:1:16 |
| D.单宁酸分子中碳、氢、氧原子个数比为38:26:23 |
不同种元素的本质区别是
| A.中子数不同 | B.电子数不同 |
| C.质子数不同 | D.相对原子质量不同 |