题目内容
【题目】为测定氧化铜和铜混合物的组成情况,某研究小组进行了如下实验。反应①、反应②均恰好完全反应。请回答问题: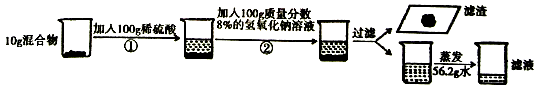
(1)反应①的化学方程式为.
(2)列出求解混合物中发生反应的物质质量(X)的比例式。
(3)混合物中氧元素与铜元素质量的最简比为。
(4)若用98%的浓硫酸配制反应①所用稀硫酸,需要浓硫酸质量为.
(5)反应①、②结束后,过滤,将滤液蒸发56.2g水,则所得溶液的溶质质量分数为.
【答案】
(1)CuO+H2SO4=CuSO4+H2O
(2)160/80=16g/X
(3)4:21
(4)10g
(5)10%
【解析】解:(1)、稀硫酸与氧化铜反应生成硫酸铜和水。化学方程式为:CuO+H2SO4=CuSO4+H2O;(2)、由反应①、反应②可知:CuO与H2SO4反应生成CuSO4 , CuSO4又与NaOH发生反应。故设参加反应的CuO的质量为X。
CuO-- CuSO4--- | 2NaOH |
80 | 80 |
x | 100g×8%=8g |
![]()
或先求出CuSO4与NaOH反应时CuSO4的质量,在求参加反应的CuO的质量。
设CuSO4与NaOH反应时CuSO4的质量为A。
CuSO4--- | 2NaOH |
160 | 80 |
A | 100g×8%=8g |
![]()
A=16g
设参加反应的CuO的质量为X。
CuO-- | CuSO4 |
80 | 160 |
x | 16g |
![]() ;(3)通过计算可知混合物中氧化铜的质量为8g,则铜的质量为:10g-8g=2g。
;(3)通过计算可知混合物中氧化铜的质量为8g,则铜的质量为:10g-8g=2g。
所以混合物中氧元素与铜元素质量的最简比为:(8g× ![]() ): (2g+8g×
): (2g+8g× ![]() )=4:21(4)、设CuO与H2SO4反应需要硫酸的质量为B。
)=4:21(4)、设CuO与H2SO4反应需要硫酸的质量为B。
CuO-- | H2SO4 |
80 | 98 |
8g | B |
![]()
B=9.8g
设用98%的浓硫酸配制反应①所用稀硫酸,需要浓硫酸质量为M。
98%M=9.8g
M=10g(5)、设反应生成硫酸钠的质量为N,生成氢氧化铜的质量为Q。
2NaOH+ CuSO4= | Na2SO4+ | Cu(OH)2↓ |
80 | 142 | 98 |
8g | N | Q |
![]()
N=14.2g
Q=9.8g
反应后溶液的质量为:10g+100g+100g-9.8g-56.2g-2g=142g
W= ![]() =10%
=10%
答:所得溶液的溶质质量分数为:10%。
所以答案是:CuO+H2SO4=CuSO4+H2O;160/80=16g/X;4:21;10g;10%。

 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案