题目内容
【题目】将105.4g的稀盐酸加入盛到有12.5g石灰石粉末(杂质不溶解于水,也不与盐酸反应)的烧杯中,恰好完全反应,反应后烧杯中剩余物质的总质量为113.5g。求:
(1)生成二氧化碳的质量为_____________g。
(2)石灰石中碳酸钙的质量分数是多少_________?
(3)反应后所得溶液的溶质的质量分数是多少_______________?
【答案】4.480%。10%
【解析】
(1)根据质量守恒定律,产生的二氧化碳的质量=12.5g+105.4g-113.5g=4.4g
(2)解:设石灰石中碳酸钙的质量为x,生成氯化钙的质量为y
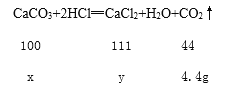
![]() =
=![]() =
=![]() 解得x=10g,y=11.1g
解得x=10g,y=11.1g
故石灰石中碳酸钙的质量分数=![]() ×100%=80%
×100%=80%
答:石灰石中碳酸钙的质量分数为80%。
(3)石灰石样品杂质质量=12.5g-10g=2.5g,故最终所得溶液的质量=113.5g-2.5g=111g,由(2)可知,溶液中氯化钙的质量为11.1g,故最终所得溶液的溶质质量分数=![]() ×100%=10%
×100%=10%
答:最终所得溶液的溶质质量分数为10%。

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目