题目内容
【题目】水与我们的生活息息相关。
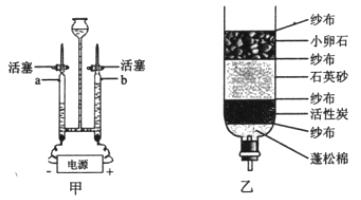
(1)图甲是电解水的装置,a客产生的气味是____________。电解水的化学方程为____________。
(2)图乙是简易净水器,可利用了活性炭的____________作用,除去水中的色素和异味。漂白粉可用于用水消毒,其有效成分为Ca(ClO)2,工业上制备漂白粉的化学方程式为:2Cl2+2Ca(OH)2=X+Ca(ClO)2+2H2O,则X的化学式为_____________。
(3)实验室配制50g16%的氯化钠溶液,需要称量氯化钠_________g,量取水时仰视读数会造成溶质的质量分数_________(填“偏小”“不变”或“偏大”),溶解时玻璃棒的作用是________。
【答案】 氢气(H2) 2H2O![]() 2H2↑+ O2↑ 吸附 CaCl2 8 偏小 搅拌加速溶解
2H2↑+ O2↑ 吸附 CaCl2 8 偏小 搅拌加速溶解
【解析】(1)图甲是电解水的装置,a管产生的气体是电源的负极产生的气体较多是氢气,电解水生成了氢气和氧气,反应的化学方程式为:2H2O![]() 2H2↑+O2↑;(2)由于活性炭具有吸附性,在简易净水器中,可利用了活性炭的吸附作用,除去水中的色素和异味;根据反应的化学方程式2Cl2+2Ca(OH)2═X+Ca(ClO)2+2H2O,反应物中氯、钙、氧、氢原子个数分别为4、2、4、4,反应后的生成物中氯、钙、氧、氢原子个数分别为2、1、4、4;根据反应前后原子种类、数目不变,则每个X分子由1个钙原子和2个氯原子构成,则物质X的化学式为:CaCl2; (3)实验室配制50g16%的氯化钠溶液,需要测量氯化钠是:50g×16%=8g,量取水时仰视读数,实际量取的水多了,会造成溶质的质量分数偏小,溶解时玻璃棒的作用是:搅拌加速溶解。
2H2↑+O2↑;(2)由于活性炭具有吸附性,在简易净水器中,可利用了活性炭的吸附作用,除去水中的色素和异味;根据反应的化学方程式2Cl2+2Ca(OH)2═X+Ca(ClO)2+2H2O,反应物中氯、钙、氧、氢原子个数分别为4、2、4、4,反应后的生成物中氯、钙、氧、氢原子个数分别为2、1、4、4;根据反应前后原子种类、数目不变,则每个X分子由1个钙原子和2个氯原子构成,则物质X的化学式为:CaCl2; (3)实验室配制50g16%的氯化钠溶液,需要测量氯化钠是:50g×16%=8g,量取水时仰视读数,实际量取的水多了,会造成溶质的质量分数偏小,溶解时玻璃棒的作用是:搅拌加速溶解。

 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】某校学校小组的同学为了测定某石灰石中碳酸钙的质量分数,他们取该石灰石样品 10g 加入烧杯中,再把 100g 稀盐酸分四次加入,实验过程所得数据如下表(已知石 灰石样品中含有的杂质既不溶于水,也不与稀盐酸反应):
实验次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 |
加入稀盐酸的质量/g | 25 | 25 | 25 | 25 |
剩余固体的质量/g | 7 | 4 | 2.6 | m |
分析表中数据,完成下列问题:
(1)表中 m 的数值为_____。
(2)求实验中所用盐酸的质量分数为__________。
(3)计算第 1 次试验反应结束后所得溶液中溶质质量分数为__________。