题目内容
【题目】化学反应中有些反应没有明显现象,需要设计实验证明化学反应是否发生。中考前夕,彦飞学习小组的同学们来到实验室,利用所学知识对“氢氧化钠溶液与二氧化碳能否发生反应?”进行再探究。
(提出问题)氢氧化钠溶液与二氧化碳能否发生反应?
(猜想假设)小中:不能发生反应。小雅:可以发生反应。
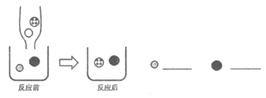
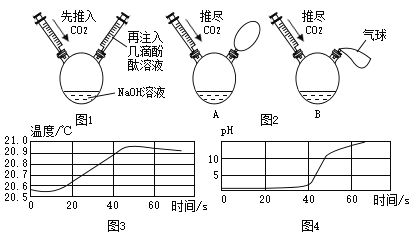
(实验探究)小中同学设计实验如图1所示:
(评价交流)(1)小中的实验_____(填“能”或“不能”)得出正确结论。小雅也选择了和小中一样的实验装置,将药品“几滴酚酞溶液”换成了“足量稀盐酸”,实验过程中,刚开始注入稀盐酸一段时间内未观察到明显现象,请你解释原因②_____。小雅的实验需要保证稀盐酸为足量,若将稀盐酸换为③_____,则不需保证加入的试剂为足量也可得出结论。
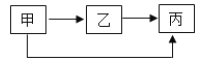
(改进实验)(2)同学们从装置上进行创新,已知实验前A、B装置底部液体体积、注射器内二氧化碳的体积以及气球的体积均相等,且装置气密性良好。推尽CO2一段时间后,观察到两装置的变化情况如图2,请分析回答:
①已知A、B装置底部分别盛有水和NaOH溶液中的一种,请你根据实验现象推测,盛有NaOH溶液的装置是_____(选填“A”或“B”);需要另一装置用等量的水做实验的目的是_____。
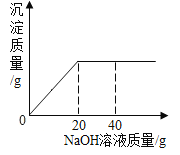
(拓展应用)(3)同学们又从数据表达的形式上进行创新,对另一个典型的没有现象的反应“NaOH溶液和稀盐酸的反应”进行了再探究,绘制出如图所示的两幅曲线图3、图4:由图3曲线可知,此反应是一个放热反应,图4曲线上A点所对应的溶液中的离子组成是_____(填离子符号)。
【答案】不能 氢氧化钠过量,盐酸先与氢氧化钠反应生成水和氯化钠,无明显现象发生 氯化钙溶液 B 排除二氧化碳溶于水、及二氧化碳与水反应对实验的干扰 Na+、Cl﹣、OH﹣
【解析】
氢氧化钠与碳酸钠同时存在时,盐酸先与氢氧化钠,此反应无气体和沉淀生成,无法观察实验现象,碳酸根与钙离子生成碳酸钙沉淀。
[评价交流](1)氢氧化钠和碳酸钠形成的溶液都显碱性,加入酚酞都变红,故小中的实验不能判断氢氧化钠与二氧化碳是否发生了反应,加入盐酸,盐酸先与未反应完的氢氧化钠发生中和反应,此时无气体和沉淀生成,只有水和可溶性的盐生成,所以观察不到现象,故原因是氢氧化钠过量,盐酸先与氢氧化钠反应生成水和氯化钠,无明显现象发生。二氧化碳与氢氧化钠反应后生成碳酸钠和水,碳酸钠中碳酸根可与钙离子生成沉淀,因此加入含有钙离子的溶液,根据是否有沉淀,判断二氧化碳与氢氧化钠是否发生反应,故将稀盐酸换为氯化钙溶液,则不需保证加入的试剂为足量也可得出结论。
[改进实验](2)①二氧化碳与氢氧化钠反应,气体被吸收,内部气体减少,压强变小,外界大气压将气球压瘪,所以气球变小的为盛有氢氧化钠溶液的装置,故盛有NaOH溶液的装置是B,氢氧化钠溶液中有水,为了排出水的影响,需要进行对照实验,排出水的影响,故需要另一装置用等量的水做实验的目的是排除二氧化碳溶于水、及二氧化碳与水反应对实验的干扰。
[拓展应用](3)由A点pH可知此时溶液显碱性,氢氧化钠与盐酸反应生成氯化钠和水,氯化钠显中性,而溶液显碱性,说明氢氧化钠有剩余,所以溶质为氯化钠和氢氧化钠,离子为钠离子、氯离子和氢氧根离子,离子符号为Na+、Cl﹣、OH﹣。

 走进文言文系列答案
走进文言文系列答案