题目内容
【题目】现有不纯的氧化铜样品16g,可能混有氧化铁、氧化镁、木炭粉、氯化钠中的一种或几种,加入200g稀硫酸酸,恰好完全反应,没有固体剩余,生成3.6g水,则下列判断正确的是
A.原固体样品中肯定含有木炭粉
B.原固体样品中只混有氧化镁
C.恰好完全反应后,溶液中水的质量为184g
D.所用的稀硫酸中溶质质量分数为19.6%
【答案】C
【解析】
生成的3.6g水中氧元素全部来自固体样品,固体样品中氧元素的质量=3.6g×![]() =3.2g,则3.6g水中的氢元素质量全部来来自硫酸,则硫酸中的氢元素质量=3.6g-3.2g=0.4g,则硫酸的质量=
=3.2g,则3.6g水中的氢元素质量全部来来自硫酸,则硫酸中的氢元素质量=3.6g-3.2g=0.4g,则硫酸的质量=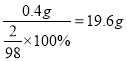 ,硫酸溶液中水的质量=200g-19.6g=180.4g;
,硫酸溶液中水的质量=200g-19.6g=180.4g;
A、混合固体中加入稀硫酸没有固体剩余,说明没有木炭粉;故选项错误;
B、固体样品中氧元素质量分数=![]() ,氧化铜中氧元素质量分数=
,氧化铜中氧元素质量分数=![]() ,氧化镁中氧元素的质量分数=
,氧化镁中氧元素的质量分数=![]() ,氧化铁中氧元素的质量分数=
,氧化铁中氧元素的质量分数=![]() ,氧化镁和氧化铁的氧元素质量分数均大于20%,则固体混合物中一定含有氯化钠,至少含有氧化铁或氧化镁其中一种;故选项错误;
,氧化镁和氧化铁的氧元素质量分数均大于20%,则固体混合物中一定含有氯化钠,至少含有氧化铁或氧化镁其中一种;故选项错误;
C、该反应符合质量守恒定律,恰好完全反应后,溶液中水的质量=180.4g+3.6g=184g;故选项正确;
D、所用的稀硫酸中溶质质量分数=![]() ;故选项错误;
;故选项错误;

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】某化学兴趣小组同学学习了解碱盐的知识后,到实验室做碳酸钠与盐酸反应的实验。
小华实验:取![]() 溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;
溶液于试管中,再用胶头滴管滴入少量稀盐酸,无明显现象;
小红实验:取2mL稀盐酸于试管中,再用胶头滴管滴入少量![]() 溶液,马上观察到有气泡产生。两人实验所用的
溶液,马上观察到有气泡产生。两人实验所用的![]() 溶液、稀盐酸均相同,却观察到不同的实验现象,他们为查明原因,进行了以下探究。
溶液、稀盐酸均相同,却观察到不同的实验现象,他们为查明原因,进行了以下探究。
(查阅资料)
①盐酸和![]() 溶液反应是分步进行的,即:反应1:
溶液反应是分步进行的,即:反应1:![]() 先
先![]() ;反应2:
;反应2:![]() 后
后![]()
②![]() 溶液与石灰水混合会变浑浊
溶液与石灰水混合会变浑浊
③![]() 可溶于水
可溶于水
(提出问题)小华实验没有观察到气体产生,是否只发生了“反应1”呢?
(思考分析)要证明只发生了“反应1”,需要证明![]() 的存在,若只发生了“反应1”,则小华实验后的溶液中除了有
的存在,若只发生了“反应1”,则小华实验后的溶液中除了有![]() 和NaCl,还可能有过量的
和NaCl,还可能有过量的![]() ,而
,而![]() 对
对![]() 的检验是有干扰的,设计实验时要考虑排除这个物质的干扰。
的检验是有干扰的,设计实验时要考虑排除这个物质的干扰。
(预计实验)
实验操作 | 现象预期 | 实验目的及反应方程式 |
步骤1:取少量小华实验后的溶液于试管中, ______ | 如果溶液中有 | 验证是否含有 |
步骤2 ______ | 如果小华实验后的溶液中有 | 证明 |
(交流反思)小红实验与小华实验有不同现象的原因是______。