题目内容
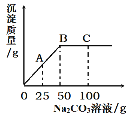
【题目】如图为氯化铵和硝酸钾的溶解度曲线,请你根据曲线回答以下问题:
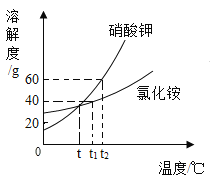
(1)当氯化铵的溶液较稀时,降温不能使其变为饱和溶液,此时可采用向溶液中加入氯化铵固体和_____的方法来使其变为饱和溶液;
(2)t℃时,分别将硝酸钾和氯化铵的饱和溶液升温到t2℃,所得溶液的溶质质量分数为硝酸钾_____氯化铵(填“大于”“小于”或“等于”);
(3)t2℃时,向 xg硝酸钾的饱和溶液中加入 70g水得到20%的溶液,则 x=_____g
【答案】蒸发水(或蒸发溶剂) 等于 80
【解析】
(1)当氯化铵的溶液较稀时,降温不能使其变为饱和溶液,是因为该溶液中溶质较少,溶剂较多,所以,可采用向溶液中加入溶质氯化铵固体和蒸发水(或蒸发溶剂)的方法来使其变为饱和溶液;
(2)t℃时,硝酸钾和氯化铵的饱和溶液的溶解度相同,溶质质量分数也相同,当温度升到t2℃,两种溶液中的溶质质量和溶剂质量都不变,所以溶液的溶质质量分数也不变,则硝酸钾溶液的溶质质量分数等于氯化铵溶液的溶质质量分数;
(3)t2℃时,硝酸钾的饱和溶液的溶解度为60g,则溶质质量分数为![]() , 向 xg硝酸钾的饱和溶液中加入 70g水得到20%的溶液,则有:
, 向 xg硝酸钾的饱和溶液中加入 70g水得到20%的溶液,则有:![]() ,解得 x=80g。
,解得 x=80g。

【题目】某校兴趣小组同学准备进行常见酸、碱、盐的性质探究实验时,发现实验台上摆放的药品中,有一瓶装溶液的试剂瓶未盖瓶盖且标签破损(如图所示),于是小组同学决定对这瓶溶液进行实验探究:
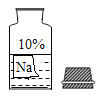
(提出问题)该试剂的成分是什么?
(交流讨论)根据受损标签的情况判断,这瓶试剂不可能是______(填字母)
A 酸 B 碱 C 盐
(查阅资料)
I.初中化学常见的含钠化合物有NaCl、NaOH,Na2CO3、NaHCO3
Ⅱ.Na2CO3、NaHCO3溶液都呈碱性。
Ⅲ.室温(20℃)时,上述四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)小华根据试剂瓶标注的溶质质量分数10%和上表中溶解度的数据判断这瓶试剂不可能是______
(做出猜想)①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液
(设计并进行实验)
(1)小强用洁净的玻璃棒蘸取该溶液滴在pH试纸上,测得pH>7,则猜想______错误。
(2)小强为了确定该溶液的成分,他又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加足量的___________(填试剂的名称) | 产生大量的气泡 | 猜想 ②正确 |
老师指出该结论不严谨。理由是氢氧化钠溶液在空气中敞口放置会发生变质,变质后也能产生上述现象。请写出氢氧化钠在空气中变质的化学方程式:______。
(继续探究)另取样加入过量的CaCl2溶液,观察到有______产生,设计这一步骤的目的是_____,静置后,取上层清液,滴入无色酚酞溶液,溶液呈红色。
(实验结论)这瓶溶液原来是______。
(探究启示)做实验时取完药品后应______。
【题目】20°C时,某物质溶解于水的实验数据如下表。则下列叙述正确的是( )
实验序号 | 水的质量/g | 加入该物质的质量/g | 剩余未溶解固体的质量/g |
① | 10 | 2 | 0 |
② | 10 | 3 | 0 |
③ | 10 | 4 | 0.4 |
④ | 10 | 5 | 1.4 |
A.溶液质量由大到小的顺序为④>③>②>①
B.20℃时10g饱和溶液溶有3.6g该物质
C.20℃时10g水最多溶解3.6g该物质
D.①所得溶液的溶质质量分数为20%