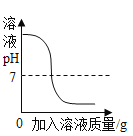
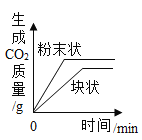
��Ŀ����
����Ŀ���������ƾ��壨NaClO4�� H2O���������Ʊ������ᡣ���γ�ȥ��ɳ�Ȳ��������ʺ�õ�����������ֻ�� MgCl2��CaCl2 �������ʣ�������������Ϊԭ���Ʊ��������ƾ�����������£�
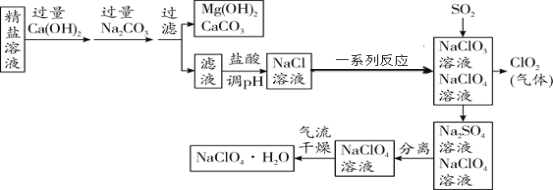
�����ϣ����������ڽϸ��¶����ֽ⡣��ش��������⣺
��1�������м������ Ca��OH��2 ���� Na2CO3 ��˳���ܷ�Ե������ܻ��ܣ�_______��Ϊʲô_______��
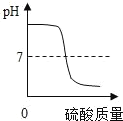
��2��д����������� pH �Ļ�ѧ����ʽ_______��дһ������
��3��ClO2 �Ļ�ѧ����Ϊ______��ͨ�� SO2 ��Ϊ�˳�ȥNaClO4 ��Һ�������� NaClO3���÷�Ӧ�����������ʣ���д����ѧ����ʽ_________��
��4��������������ʱ���¶�Ӧ������ 75�桫95�棬��ԭ����______��
��5��NaClO4 ��Һ�е���������_________��д��ѧ���ţ�����μ��� NaClO4 ��Һ���Ƿ���Na2SO4_________��
���𰸡����� �Ե�������Ca2+û�취��ȥ���������T�ɣ� Na2CO3+2HCl=2NaCl+H2O+CO2����NaOH+HCl=NaCl+H2O �������� 2NaClO3��SO2 = Na2SO4��2ClO2 �¶ȹ��ߣ����������ֽ⣻�¶ȹ��ͣ����ﲻ��֣���75 ����95 �����������Ҹ������ƾ��岻�ֽ⣩ ![]() ���Թ�ȡ��Ʒ��Һ�������ᱵ�����Ȼ�������Һ�����Ƿ�����
���Թ�ȡ��Ʒ��Һ�������ᱵ�����Ȼ�������Һ�����Ƿ�����
��������
��1���������м������Na2CO3 Ŀ���dz�ȥ�Ȼ��ƺ�����Ca��OH��2��˳���ܶԵ�������Ե�����ô������Ca2+����ȥ��
��2���ڳ��ӹ����У������������ƺ�����̼���ƣ�������Һ�ʼ��ԣ����������ȥ�������ƺ�̼���ƣ�������Һ��pH��������Ӧ�Ļ�ѧ����ʽ��Na2CO3+2HCl=2NaCl+H2O+CO2����NaOH+HCl=NaCl+H2O��
��3�����������������������ClO2 ������Ϊ�������ȡ�ͨ��SO2��Ϊ�˳�ȥNaClO4 ��Һ�������� NaClO3���������Ⱥ������Ʒ�Ӧ���������ƺͶ����������壬��ѧ����ʽΪ2NaClO3��SO2 = Na2SO4��2ClO2��
��4��������������ʱ���¶�Ӧ������ 75�桫95�棬ԭ�����¶ȹ��ߣ����������ֽ⣻�¶ȹ��ͣ����ﲻ��֡�
��5���ӻ�ѧʽ�жϣ�NaClO4 �����Σ��ɽ��������Ӻ���������ӹ��ɣ���Ԫ�صĻ��ϼ�Ϊ+1�ۣ����������Ļ��ϼ�Ϊ-1�ۣ�������Һ�е��������Ǹ���������ӣ�����Ϊ![]() ������������뱵���ӽ�ϻ��������ᱵ���������Թ�ȡ������NaClO4 ��Һ�������е������ᱵ��Һ�����Ƿ����ǣ������Һ����ǣ�����Na2SO4��
������������뱵���ӽ�ϻ��������ᱵ���������Թ�ȡ������NaClO4 ��Һ�������е������ᱵ��Һ�����Ƿ����ǣ������Һ����ǣ�����Na2SO4��

 Сѧ�̲���ȫ���ϵ�д�
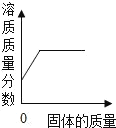
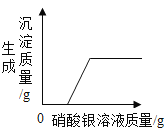
Сѧ�̲���ȫ���ϵ�д�����Ŀ�����ó������ɲⶨij������Ʒ�Ĵ���(�ٶ������е�����ȫ����MgCl2)��ÿ��ȡ100 g��Ʒ���Ƴ���Һ�������м�����������Ϊ10%������������Һ��������ɳ�������������������������Һ��������ϵ���±���ʾ��
�ⶨ���� | ��һ�� | �ڶ��� | ������ | ���Ĵ� |
��Ʒ����/g | 100 | 100 | 100 | 100 |
����������Һ����/g | 32 | 64 | 82 | 90 |
��������/g | 2.32 | 4.64 | 5.8 | 5.8 |
��1������εĴ���________��
��2������Ʒ����������������Һǡ����ȫ��Ӧʱ������Һ���Ȼ��Ƶ�����________��(д���������)
����Ŀ��ijУͬѧ��չ����ͼ��ʾ������Һ����Եļ�������ʵ����
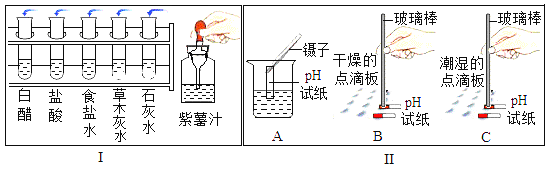
��1�������Ƶ���ɫ����֭��ͼ![]() ��ʾ�ֱ�μӵ��Թ��У��۲쵽���������±���ʾ��
��ʾ�ֱ�μӵ��Թ��У��۲쵽���������±���ʾ��
��Һ | �״� | ���� | ����ˮ | ��ľ��ˮ | ʯ��ˮ |
��������֭�����ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ | ��ɫ |
��ͼ![]() �д������֭����������Ϊ________��
�д������֭����������Ϊ________��
�ڸ����ϱ��Ʋ⣬����֭�������ָʾ��������ϡ���������ʾ����ɫ��________��
��2����pH��ֽ�ⶨͼ![]() �в�����Һ�����ȣ���ľ��ˮ
�в�����Һ�����ȣ���ľ��ˮ![]() ������________
������________![]() ����������������������������
����������������������������![]() ��Һ���״�pH________
��Һ���״�pH________![]() ����
����![]() ����
����![]() ������
������![]() ��
��![]() ��
��
��3��ͼ![]() ����λͬѧ�ֱ�ⶨ�������ȵIJ���ʾ��ͼ��������ȷ����________
����λͬѧ�ֱ�ⶨ�������ȵIJ���ʾ��ͼ��������ȷ����________![]() ����A����B������C������ͬ
����A����B������C������ͬ![]() �����ܵ���������ҺpH�����ı�Ĵ��������________������ⶨ����ʯ��ˮ����õ�pH��________
�����ܵ���������ҺpH�����ı�Ĵ��������________������ⶨ����ʯ��ˮ����õ�pH��________![]() ����ƫ����������������ƫС��
����ƫ����������������ƫС��![]() ������ȷ�ⶨ��ҺPH�IJ������裺________��
������ȷ�ⶨ��ҺPH�IJ������裺________��