题目内容
酸雨的危害很大,硫酸型酸雨的形成一有以下两种途径:
(1)正常雨水略显酸性,主要原因是 .
(2)pH<5.6的降水称为酸雨,它会使土壤酸化,施用适量 可改良土壤酸性.
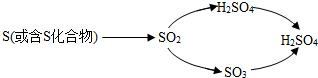
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),我们可利用此原理来测定空气中SO2的含量.SO2的变化过程可表示为:SO2
H2SO4
请写出该反应的化学方程式: .

(1)正常雨水略显酸性,主要原因是
(2)pH<5.6的降水称为酸雨,它会使土壤酸化,施用适量
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),我们可利用此原理来测定空气中SO2的含量.SO2的变化过程可表示为:SO2
| +(I2,H2O) |
请写出该反应的化学方程式:
考点:酸雨的产生、危害及防治,二氧化碳的化学性质,常见碱的特性和用途,书写化学方程式、文字表达式、电离方程式
专题:化学与环境保护
分析:(1)根据空气中含有二氧化碳,二氧化碳能和水反应生成碳酸,所以正常的雨水呈弱酸性解答;
(2)根据酸雨的危害很大,能够腐蚀建筑物、毁坏森林树木、使土壤酸化,酸碱中和解答;
(3)根据质量守恒定律写出化学方程式.
(2)根据酸雨的危害很大,能够腐蚀建筑物、毁坏森林树木、使土壤酸化,酸碱中和解答;
(3)根据质量守恒定律写出化学方程式.
解答:解:
(1)正常的雨水因为含有碳酸而显酸性.二氧化碳和水反应生成碳酸,碳酸的溶液显酸性;
(2)酸雨的危害很大,如土壤酸化、腐蚀建筑物等,农业上常用熟石灰来调节酸性土壤;
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),化学方程式为:SO2+2H2O+I2═H2SO4+2HI.
答案:
(1)二氧化碳和水反应生成碳酸,碳酸的溶液显酸性;
(2)熟石灰;
(3)SO2+2H2O+I2═H2SO4+2HI.
(1)正常的雨水因为含有碳酸而显酸性.二氧化碳和水反应生成碳酸,碳酸的溶液显酸性;
(2)酸雨的危害很大,如土壤酸化、腐蚀建筑物等,农业上常用熟石灰来调节酸性土壤;
(3)SO2通入碘水(I2的水溶液)会生成硫酸(H2SO4)和氢碘酸(HI),化学方程式为:SO2+2H2O+I2═H2SO4+2HI.
答案:
(1)二氧化碳和水反应生成碳酸,碳酸的溶液显酸性;
(2)熟石灰;
(3)SO2+2H2O+I2═H2SO4+2HI.
点评:解答本题要掌握化学方程式的书写方法和酸雨的危害等方面的知识,只有这样才能对问题做出正确的判断.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目

 现有A~G七种物质,已知A是赤铁矿石的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系.
现有A~G七种物质,已知A是赤铁矿石的主要成分,E的浓溶液稀释时会放出大量的热,G溶液为蓝色,它们之间存在如图所示的转化关系. 质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题.
质量守恒定律是一条重要规律,请利用该规律的相关知识回答下列问题. 某校化学兴趣小组同学学习了“用红磷燃烧测定空气中氧气含量”实验之后,认为课本上实验存在不足,实验小组同学在教师的指导下将原装置改进如图所示,成功的测出空气中氧气的含量.以下是他们的探究过程:
某校化学兴趣小组同学学习了“用红磷燃烧测定空气中氧气含量”实验之后,认为课本上实验存在不足,实验小组同学在教师的指导下将原装置改进如图所示,成功的测出空气中氧气的含量.以下是他们的探究过程: