题目内容
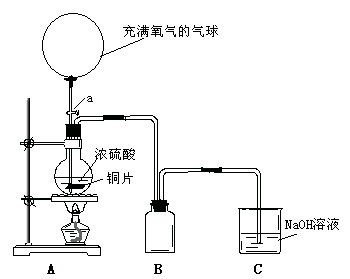
某化学课外兴趣小组为探究铜跟硫酸的反应情况,设计了下图所示装置进行有关实验:
(1)先关闭活塞a,将6.4g铜片和12mL18mol/L的浓硫酸放在圆底烧瓶中共热至反应完毕,发现烧瓶中还有铜片剩余。再打开活塞a,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生的化学方程式:
, ;
②B是用来收集实验中产生的气体的装置,但导管未画全,请直接在原图上把导管补充完整。
③实验结束后,装置C中的溶液中可能含有的溶质有 ;
(2)事实表明,上述反应全部结束后,硫酸仍有剩余。为定量测定剩余酸的物质的量浓度,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定剩余酸的物质的量浓度。他认为测定SO2的量的方法有多种,请你写出其中的一种
;
②乙学生设计的方案是:将反应后的溶液冷却后全部移入100mL容量瓶中并加蒸馏水定容,取20ml于锥形瓶中,用酚酞作指示剂,用标准氢氧化钠溶液进行滴定,再求出余酸的物质的量的浓度。你认为乙学生设计的实验方案能否准确求得余酸的物质的量的浓度
(填“能”或“否”),理由是 。
①Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O, (2分)
CuSO4 + SO2↑+ 2H2O, (2分)
2Cu+2H2SO4+O2=2CuSO4+2H2O (2分) ②?B装置中导气管长进短出 (2分)
③?Na2SO3、Na2SO4、NaOH (2分)
(2)①?在通入O2之前,用排饱和NaHSO3溶液的方法测出装置A产生气体的体积(2分)
②?否 (1分) 用酚酞作指示剂时溶液中的Cu2+会和NaOH反应,Cu2+的蓝色会干扰滴定终点的正确判断(2分)

 导学全程练创优训练系列答案
导学全程练创优训练系列答案
资料卡:
(1)K、Ca、Na等活泼金属的氧化物均可与水反应生成对应的碱;
(2)钠为银白色金属,过氧化钠为淡黄色固体.
(一)提出问题:白色固体含有什么物质?
(二)猜想与假设:
假设1:白色固体含有
假设2:白色固体含有Na2O;
(三)实验设计:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量白色固体放入足量水中 | 白色固体完全溶解 | |
| ②取①中少量溶液,加入 |
产生大量气泡 | 假设1成立 |
| ③另取①中少量溶液, |
假设2成立 |
Na在CO2中燃烧存在多个反应、生成多种物质.请你写出其中生成物仅为一种白色固体与一种黑色固体的反应的化学方程式:
(6分)某化学课外兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置A中有黑色固体和白色固体生成。

【资料卡】
(1)K、Ca、Na等活泼金属的氧化物均可与水反应生成对应的碱;
(2)钠为银白色金属,过氧化钠为淡黄色固体。
【提出问题】白色固体含有什么物质?
【猜想与假设】
假设1:白色固体含有 ▲ ;
假设2:白色固体含有Na2O;
【实验设计】
|
实验步骤 |
实验现象 |
实验结论 |
|
①取少量白色固体放入足量水中 |
白色固体完全溶解 |
|
|
②取①中少量溶液,加入 ▲ |
产生大量气泡 |
假设1成立 |
|
③另取①中少量溶液, ▲ |
▲ |
假设2成立 |
【反思提高】
Na在CO2中燃烧存在多个反应、生成多种物质。请你写出其中生成物仅为一种白色固体与一种黑色固体的反应的化学方程式: ▲ 。
 (2013?苍梧县二模)某化学课外兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置A中有黑色固体和白色固体生成.
(2013?苍梧县二模)某化学课外兴趣小组为探究Na与CO2的反应进行了如下实验(实验部分装置如右图所示):向盛有Na的装置A中通入纯净、干燥的CO2,当观察到装置B中刚好出现浑浊时,点燃酒精灯,同时继续缓缓通入CO2,Na剧烈燃烧,产生白烟,燃烧结束后装置A中有黑色固体和白色固体生成.
