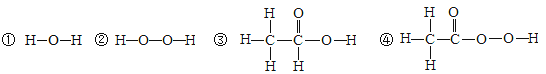题目内容
【题目】观察下列原子结构示意图和元素周期表(部分),回答有关问题。
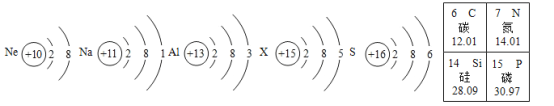
(1)具有相对稳定结构的原子是______,属 于金属元素的是______________________。
(2)含有X元素的化合物常用作化肥,X元素的原子序数是_____,相对原子质量为______________________。
(3)高纯度的晶体硅是制作芯片的重要物质,它是由____________________(填微粒名称)构成的。
(4)在某金属单质与硫反应的过程中,硫原子得到2个电子形成硫离子。下列说法正确的是______________________(填字母序号)。
A 硫离子属于阴离子
B 硫离子的核外电子数与质子数相等
C 硫离子可表示为S2+
D “S”既可以表示硫原子,也可以表示硫元素
【答案】Ne Na和Al 15 30.97 硅原子 AD
【解析】
(1)图中的粒子中,氖原子的最外层有8个,化学性质稳定;钠元素与铝元素属于金属元素;故填:Ne;Na和Al;
(2)粒子X的质子数为15,即其原子序数为15,是磷元素,其相对原子质量为30.97;
(3)硅属于固态的非金属单质,是由硅原子构成的;
(4)A 硫离子是硫原子得到2个电子形成,带有2个单位的负电荷,属于阴离子,故A正确;
B 硫离子是由硫原子得到2个电子后形成的,所以硫离子的核外电子数与质子数不相等,故B错误;
C 硫离子是硫原子得到2个电子形成,带有2个单位的负电荷,硫离子可表示为S2-,故C错误;
D “S”是硫元素的元素符号,既可以表示硫原子,也可以表示硫元素,故D正确。故选AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某兴趣小组的同学对错的某些性质进行相关探究。
[提出问题]铝能否与水反应生成氢气?
物质 | 钠与水 | 铝与水 | 汞与水 |
能否发生反应 | 能反应 | 能反应 | 不反应 |
[查阅资料]如图:
[交流与讨论]
(1)铝在空气中与氧气反应形成保护膜,写出铝与氧气反应的化学方程式_____________________。
(2)要除去铝表面氧化铝薄膜,可以将铝片漫入氯化汞( HgCl2)溶液中,形成铝汞齐(铝汞合金)破坏铝表面致密的氧化膜且防止其重新生成。铝与氯化汞溶液发生置换反应的化学方程式为______________________。
[实验探究]
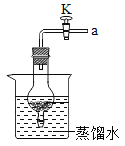
(1)将铝片完全浸入氯化汞(HgCl2)溶液中1分钟左右后取出。立即用水冲洗干净后加入到蒸馏水中,表面生成大量气泡,周围出现白色沉淀。在导管口处涂肥皂水,发现有气泡形成。用燃着的木条点燃气泡,发出爆鸣声,对应化学方程式为_____________________。
[实验结论]铝能与水反应生成氢气。
请写出铝与水反应生成氢氧化铝和氢气的化学方程式_____________________。
[实验反思]
(1)若反应使用如图装置,关闭导管上的活塞K,反应停止,其原理是_____________________。当再次打开活塞K,反应继续,产生气泡。铝未能生成氧化铝,其原因是_____________________。