题目内容
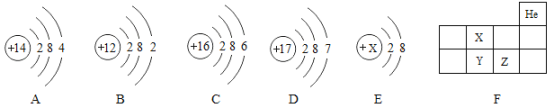
【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。如图是某回收工厂要从X、铜、锌、银四种金属组成的混合物中分离某贵重金属的流程图:
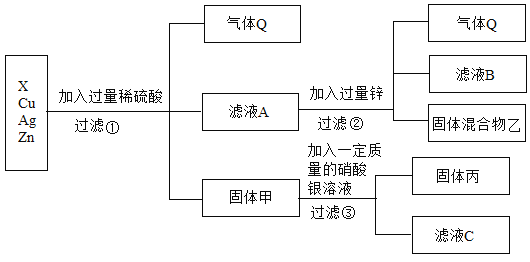
请回答:
(1)气体Q的化学式为:_____;
(2)四种金属的活动性顺序由强到弱的是________;
(3)写出金属铜与硝酸银反应的化学方程式________;
【答案】H2 Zn、X、Cu、Ag Cu+2AgNO3=Cu(NO3)2+2Ag
【解析】
根据金属的活泼性顺序:锌>氢>铜>银,故向锌、X、铜、银的金属混合物中加入稀硫酸,锌一定参加反应产生气泡,产生的气体是氢气,而铜和银一定没反应,得到的滤液A再加入过量的锌得到混合物乙和滤液B,说明锌除了和过量的硫酸反应产生气体外,还和盐溶液发生了置换反应,因此说明锌的活动性比X强,且X位于氢前;由于硫酸过量,固体甲含有铜和银,铜和硝酸银反应产生硝酸铜和银.
(1)产生的气体Q是氢气,故填:H2;
(2)四种金属的活动性顺序由强到弱的是Zn、X、Cu、Ag;故填:Zn、X、Cu、Ag;
(3)铜与硝酸银反应生成银和硝酸铜,反应的方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag;故填:Cu+2AgNO3=Cu(NO3)2+2Ag。

练习册系列答案
相关题目