题目内容
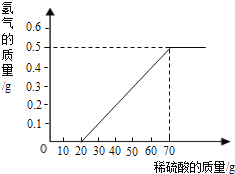
【题目】某兴趣小组用10g镁条与溶质质量分数为49%的稀硫酸反应.测得产生氢气的质量与稀硫酸的质量关系如图(假设镁条中除表面含有氧化镁外,没有其它杂质).
(1)当稀硫酸的质量为70g,产生的氢气的质量为 g.
(2)用化学方程式说明当稀硫酸的质量为10g时,为什么不产生氢气
(3)计算镁条中镁元素的质量分数(写出计算过程).
【答案】(1)0.5(2)MgO+H2SO4=MgSO4+H2O (3)84%
【解析】(1)由产生氢气的质量与稀硫酸的质量关系图可知,当稀硫酸的质量为70g,产生的氢气的质量为0.5g
(2)由于镁易于空气中的氧气反应在镁条的表面生成了氧化镁,稀硫酸首先与镁条表面的氧化镁薄膜发生了反应,所以不产生氢气,反应的方程式是:MgO+H2SO4=MgSO4+H2O
(3)有关化学方程式的就是按照有关化学方程式的简单计算的步骤:(1)设未知数(2)依据题意写方程式(3)写出相关量(4)列比例式求解(5)简单写出答案。本题中Mg条表面被空气氧化成MgO,MgO先与硫酸反应,之后Mg再与硫酸反应,但都转化为MgSO4,故可得出Mg(MgO)~H2SO4~MgSO4
(3)解:设镁元素的质量为x
由Mg+H2SO4=MgSO4+H2↑
MgO+H2SO4=MgSO4+H2O
得:Mg(MgO)~H2SO4~MgSO4
98 24
70g×49% x
![]()
x=8.4g
故镁条中镁元素的质量分数=![]()

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目