题目内容
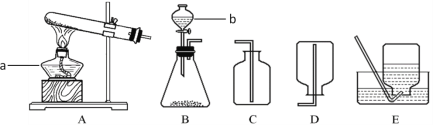
【题目】某兴趣小组为探究“氧化铁和铜粉”混合物中铜的质量分数,称取一定质量的混合物,按照下图实验装置进行实验:
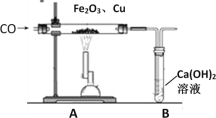
(1)实验时要“先通一氧化碳气体,后加热”的目的是_____________________。
(2)装置A中发生反应的方程式为______________________。
(3)实验装置B中的现象是____________________________, 发生反应的化学方程式为___________________________。
(4)该装置的设计有一明显不当之处,你的改进方案是_____________________。
【答案】目的是 将装置中的空气排除,防止一氧化碳与空气混合加热发生爆炸3CO+Fe2O3![]() 2Fe+3CO2澄清石灰水变浑浊CO2+Ca(OH) 2=CaCO3↓+H2O尾气含有一氧化碳,不能排入空中,用酒精灯点燃燃烧掉
2Fe+3CO2澄清石灰水变浑浊CO2+Ca(OH) 2=CaCO3↓+H2O尾气含有一氧化碳,不能排入空中,用酒精灯点燃燃烧掉
【解析】
(1)一氧化碳具有可燃性,点燃时可能发生爆炸,实验时要“先通一氧化碳气体,后加热”目的是排尽玻璃管内的空气,防止加热时发生爆炸;
(2)一氧化碳还原氧化铁生成铁和二氧化碳,实验装置A中的现象是:氧化铁由红棕色变为黑色;化学方程式为3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)实验装置B中二氧化碳通入石灰水中,现象是澄清石灰水变浑浊;发生反应的化学方程式CO2+Ca(OH)2═CaCO3↓+H2O;
(4)一氧化碳有剧毒,不能直接排放到空气中,故需将尾气点燃或用气球收集起来。

练习册系列答案
相关题目