题目内容
【题目】下图为某高钙片的外包装药品部份说明,请仔细观察、阅读后回答下列问题。
高钙片
(规格)2.5 g/片
(主要原料)碳酸钙、维生素D
(功效成份)每片中含:钙500mg
维生素D 100IU
(用法用量)每次一片,每天1次
高钙片
(规格)2.5 g/片
(主要原料)碳酸钙、维生素D
(功效成份)每片中含:钙500mg
维生素D 100IU
(用法用量)每次一片,每天1次
(1)维生素D种类较多,其中维生素D2的化学式为C28H44O
试计算维生素D2的相对分子质量为________,维生素D2中碳、氢、氧三种元素的质量比为__________。
(2)碳酸钙中钙元素的质量分数为_______。
(3)如果按用量服用,则每天补充碳酸钙的质量为_______ g。
(4)根据你对补钙产品的调查和已有的化学知识,这里的“钙”指______(填字母序号)。
A.原子 B.分子 C.单质 D.元素
【答案】396 84 : 11:4 40% 1.25 D
【解析】
(1)维生素D2的相对分子质量=12×28+1×44+16=396;维生素D2中C、H、O三种元素的质量比=(12×28):(1×44):(16×1)=84:11:4;
(2)碳酸钙中钙元素的质量分数=![]() ;
;
(3)由题意,每片含钙500mg=0.5g。每片含钙0.5g,则每片含碳酸钙的质量=![]() ,如果按用量服用,则每天补充碳酸钙的质量为1.25g;
,如果按用量服用,则每天补充碳酸钙的质量为1.25g;
(4)这里的“钙”不是以单质、氧化物、分子、原子等形式存在,这里所指的“钙”是强调存在的元素,与具体形态无关。故选D。

 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】某同学想定量测定某红色粉末中氧化铁的质量分数,进行如下实验:
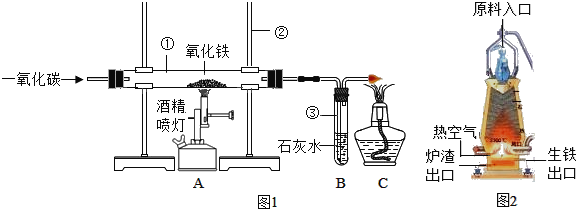
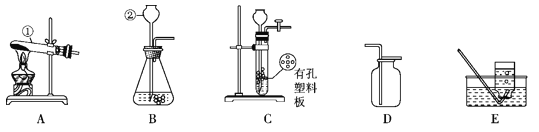
(1)图1是实验室模拟炼铁的装置图,试回答
实验步骤:按上图连接实验装置、 _______、装药品、固定实验装置后,剩下的主要实验步骤有:①通入一氧化碳;②停止通入一氧化碳;③点燃酒精灯;④熄灭酒精灯;⑤点燃酒精喷灯;⑥熄灭酒精喷灯.正确的操作顺序是(填序号)__________.
(2)实验过程中,仪器①中的现象___________,所发生反应的化学方程式是_________仪器③中所发生反应化学方程式是_______。
(3)请写出证明产物中含铁粉的一种化学方法:____________.
(4)实验过程中产生的尾气不能直接排放的原因是____________.请从节能的角度出发,对于尾气处理,你有什么好的建议:____________
(5)定量测定该红色粉末中氧化铁的质量分数
某同学称取该红色粉末5.0g装入硬质玻璃管中,完全反应后,称量相关物质的总质量其数据如下表:
反应前 | 反应后 |
玻璃管和红色粉末总质量 48.3g | 玻璃管和固体物质总质量47.1g |
根据上述表格中的实验数据计算:红色粉末中氧化铁的质量分数为____.(写出计算过程,)
(6)如图2是工业生产中炼铁高炉的结构图.实际生产中炼铁的原料有铁矿石、热空气、石灰石、以及_____________;该物质有两个作用,第一个作用提供能量,另一个作用是__________;生铁出口低于炉渣出口的原因是_________。