题目内容
下列对化学用语中“2”所表示意义的理解,正确的是
A.2Mg中的“2”表示两个镁元素 B.H2中的“2”表示两个氢原子
C.2NH3中的“2”表示2个氨分子 D.Ca2+中的“2”表示钙元素的化合价为+2价
物质除杂是化学实验中经常遇到的问题。
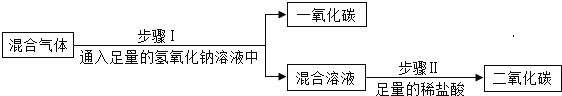
实验一:为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
实验方案 | |
方案 A |
|
方案 B |
|
方案 C |
|
上述方案中有两个方案是合理的,他们是___________写出合理方案中任意一个反应的化学方程式 ____________。
实验二:由于粗盐中含有少量 MgCl2、CaCl2、Na2SO4等杂质,不能满足化工生产的要求,因此必须将粗盐进行精制。流程如下图:
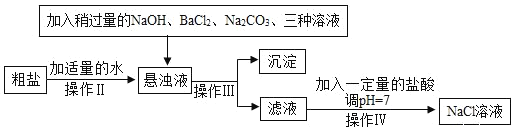
(1)加入稍过量的 Na2CO3溶液除了能除去粗盐中的 CaCl2外,它还有一个作用是 _____________(用化学方程式表示)
(2)实验操作Ⅲ是_____________,要用到的实验玻璃仪器是玻璃棒、漏斗和 ________________。
(3)如果稍过量的试剂加入的顺序依次为:Na2CO3、 NaOH、 BaCl2和盐酸,则最后得到的氯化钠溶液中一定含有杂质________________。
(4)操作Ⅳ的方法可以是:先在滤液中滴入酚酞溶液,再逐滴滴入盐酸直到滤液的 pH=7 的依据的现象是溶液由____________,如果加入的盐酸有点过量了,对后面 NaCl 溶液的结晶是否有影响______(是或否)
实验室制取气体时常要考虑下列问题:
(1)选择合理的制取装置。
用如下图所示装置制取气体,请回答下列问题。
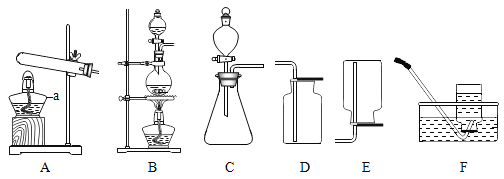
①仪器a的名称是__。
②选用A加热KMnO4制O2,装置需要改进的地方是__,反应的化学方程式为__。
③实验室用Zn和稀硫酸制取H2的化学方程式为__。
④实验室可用亚硝酸钠(NaNO2)和NH4Cl的饱和溶液加热法制备N2,应选择的发生装置和收集装置的组合是__(写出一种组合,填序号)。
(2)检验、除杂和尾气处理。
①通过饱和NaHCO3溶液洗气,可除去CO2中的HCl。洗气时化学反应方程式为__。
②实验室制备下列气体时,一般需要进行尾气处理的是__(填序号)。
a H2 b CO c CO2 d SO2
(3)反应装置的改进和反应条件的探究。
某实验小组为了探究影响H2O2分解制取氧气快慢的因素,进行了下列实验:
实验序号 | H2O2溶液的质量分数/% | H2O2溶液的体积/ml | 温度/℃ | MnO2粉末的用量/g | 收集气体的体积/ml | 收集气体所需的时间/s |
A | 5 | 1 | 20 | 0.1 | 4 | a |
B | 15 | 1 | 20 | 0.1 | 4 | b |
C | 30 | 5 | 35 | 0.1 | 4 | c |
D | 30 | 5 | 55 | 0.1 | 4 | d |
①欲探究温度对H2O2分解快慢的影响,应该选择的对照实验组是__(填实验序号)。
②该小组利用如下左图所示装置探究MnO2质量对H2O2分解快慢的影响:在三份8.0ml3%的H2O2溶液中分别加入0.03g、0.06g和0.08gMnO2粉末,获得实验数据如下右图所示(温度变化忽略不计,产生氧气的体积与装置内的压强成正比)。通过对曲线图的分析,将推理得出的结论填写在下列空白中。

结论I:在其他条件不变的情况下,所用MnO2质量越大,H2O2的分解速率__。
结论II:在其他条件不变的情况下,所用MnO2质量越大,生成氧气的总量__。