题目内容
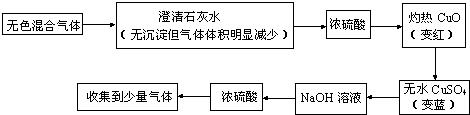
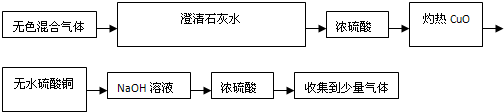
某无色混合气体中可能含有H2、CO、CO2、HCl、NH3及水蒸气中的两种或多种,当混合气体依次通过下列物质中:
(1)澄清石灰水(无浑浊现象);(2)氢氧化钡溶液(有浑浊现象);(3)浓硫酸;(4)灼热氧化铜(变红色);(5)无水硫酸铜(变蓝色).
试分析该混合气体中肯定含有
(1)澄清石灰水(无浑浊现象);(2)氢氧化钡溶液(有浑浊现象);(3)浓硫酸;(4)灼热氧化铜(变红色);(5)无水硫酸铜(变蓝色).
试分析该混合气体中肯定含有
H2、CO2和HCl
H2、CO2和HCl
;肯定不含有NH3
NH3
;可能含有CO、水蒸气
CO、水蒸气
.分析:根据二氧化碳可使澄清石灰水变浑浊,但有HCl的存在,澄清石灰水的溶质Ca(OH)2易与HCl反应,而使CO2难以与Ca(OH)2作用生成CaCO3沉淀;氢氧化钡溶液有浑浊现象又说明有二氧化碳;再根据酸碱的反应看HCl和NH3是否可以共存;最后根据氢气还原氧化铜生成水,二氧化碳一氧化碳还原氧化铜生成二氧化碳判断氢气和一氧化碳的存在.
解答:解:上述气体中,能使氢氧化钡溶液产生浑浊现象的只有CO2,在此之前先通过澄清石灰水无浑浊现象,显然是由于HCl存在所致.由于HCl的存在,澄清石灰水的溶质Ca(OH)2易与HCl反应,而使CO2难以与Ca(OH)2作用生成CaCO3沉淀,这样CO2便顺利通过Ca(OH)2溶液,继而与Ba(OH)2反应,生成BaCO3沉淀.混合气体中含HCl后,一定不含NH3,因两者反应能生成白色晶体NH4Cl.混合气体可使灼热的CuO变红,证明其中必有还原性气体CO或H2存在.通过后面实验,即再通过无水硫酸铜时会使其变蓝,证明先前的还原性气体一定有H2存在,至于CO是否存在则不能确定,由于气体多次经过溶液,无法证明原来是否含有水蒸气.所以混合气体中肯定有H2、CO2和HCl;肯定没有NH3;可能含有CO、水蒸气.
故答案为:H2、CO2和HCl;NH3;CO、水蒸气.
故答案为:H2、CO2和HCl;NH3;CO、水蒸气.
点评:本题考查了学生根据氢氧化钡溶液与二氧化碳产生碳酸钡产生沉淀,气体有CO,H2能使氧化铜还原进行分析解题的能力.

练习册系列答案
相关题目