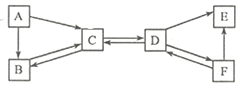
��Ŀ����
����Ŀ��ʵ���������������ַ������£�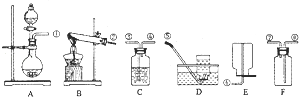
����һ��2H2O2![]() 2H2O+O2��
2H2O+O2��
��������2KMnO4![]() K2MnO4+MnO2+O2��
K2MnO4+MnO2+O2��
��1�����÷�������ȡ����ѡ��ķ�Ӧװ��Ϊ
��2�����Լ�Aװ��ʱʵ���Һ©����Ŀ����
��3�����÷���һ��ȡ���ռ�һƿ���������������Cװ�ø����������˸���ƿ��װ�е�����Ϊ������ȡ��������ռ��������밴���������õ��ܵı�Ž�װ�����Ӻ� ��
���𰸡�
��1��B
��2��ͨ������Һ������������Ʒ�Ӧ���ٶ�
��3��Ũ����٢ۢܢ�
���������⣺��1����������Ӧ����һ�������������ֿ������������ʵķ�Ӧ�������ڷֽⷴӦ�����Դ��ǣ��ֽ⣻��2�������Aװ��ʱʹ�÷�Һ©����Ŀ����ͨ������Һ������������Ʒ�Ӧ���ٶȣ���3�����÷���һ��ȡ�������ռ�һƿ��������������ڹ���������Һ����ˮ��������ȡ�������к���ˮ�֣���Ҫ��ȥˮ�֣�Ũ���������ˮ�ԣ����������������ͨ��ķ����ǡ������̳�����������ƿ�е�Ũ����ѹ�������������ˮ���ռ������ֻ����ˮ�֣�ֻ���������ſ��������������ռ�ʱӦ�ӳ����ܽ��룬�����������ܶȱȿ��������������ڼ���ƿ�ĵײ������¶��ϣ���������ƿ�����Դ��ǣ��٢ۢܢ࣮
���Դ��ǣ���1����B����2����ͨ������Һ������������Ʒ�Ӧ���ٶȣ��������ɣ�����3����Ũ��� �٢ۢܢ࣮
�����㾫�����������⣬������Ҫ�˽���������ȡװ��(����װ�ã��̹̼����͡���Һ��������)����Ҫ�����������ռ�����(�ռ�װ�ã��������ʵ��ܶȡ��ܽ��ԣ���ˮ���ռ�ʱ�������ݾ�������ð��ʱ���ռ����տ�ʼ�ų������Թ��еĿ����������ſ������ռ�����ʱ�������쵽����ƿ�ײ�)�����֪ʶ���Ǵ���Ĺؼ���

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ������������ǧ������ȡ֮��������֮���ߵľ���Դ���⣮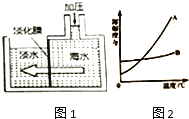
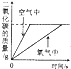
��1�������Ͽɹ�����ʹ�õĵ�ˮ��ռ��������ˮ����0.3%���Ӻ�嫵ĺ������ȡ��ˮ���Խ����ˮΣ��������Ҫ���壬��ˮ�����ķ����ܶ࣬��ͼ1�Dz���Ĥ��������ˮ��ʾ��ͼ�����Ե���Ĥ�Ҳ�ĺ�ˮ��ѹʱ���������ɵõ���ˮ����ԭ���Ǻ�ˮ�е�ˮ���ӿ���������Ĥ���������������Ӳ���������ش��������⣺
���ڻ�������ij������������У�������Ĥ��������ˮ��ԭ�����ƣ�
�ڶԵ���Ĥ�Ҳ�ĺ�ˮ��ѹ���Ҳ�ʣ����Һ�����ʵ����������������������С���������䡱֮һ��
��2����ˮ�г����̺���������Ԫ�غ�þԪ���⣬�����д����ļ�Ԫ�أ�KNO3��NaCl�ڲ�ͬ�¶�ʱ���ܽ�����±���ʾ����ش��������⣺
�¶�/�� | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
�ܽ��/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 |
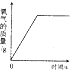
�������ϱ����ݣ��ɻ��Ƴ�KNO3��NaCl���ܽ��������ͼ2��ʾ��ͼ���ܱ�ʾKNO3�ܽ�����ߵ������A����B������
����20��ʱ����ʢ��200gˮ���ձ��м���100gKNO3 �� ����ܽ⣬�ɵõ����¶�ʱKNO3��������͡����������͡�֮һ����Һ�����ձ������ʻ���������60�棬�ڸ��¶��£����������Һ����������Һ������֮��Ϊ������������ȣ���
����Ŀ���±�������������Ԫ�صIJ�����Ϣ�����û�ѧ���ォ����������
Ԫ�ط��� | ���ӽṹʾ��ͼ | ���ӷ��� | ������ɵĵ������Ӧ�Ļ�ѧ����ʽ |
Al | Al3+ | ||
|