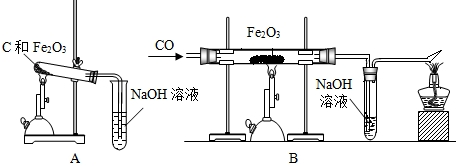
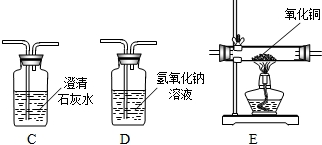
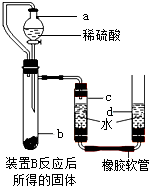
题目内容
 为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸,(杂质不与盐酸反应,也不溶于水),实验测得的数据如下图所示。(注:CaCO3+2HCl=CaCl2+H2O+CO2↑)
为了测定某石灰石中碳酸钙的质量分数,准确称取12.5g石灰石样品,研碎后放入烧杯中,向其中加入足量稀盐酸,(杂质不与盐酸反应,也不溶于水),实验测得的数据如下图所示。(注:CaCO3+2HCl=CaCl2+H2O+CO2↑)
(1)将石灰石样品研碎的目的是 。
|





 (3)求该石灰石样品中碳酸钙的质量分数
(3)求该石灰石样品中碳酸钙的质量分数
(1)增大石灰石与稀盐酸的接触面积(或加快反应速率,使反应更为充分)
(2)4.4g。
(3)解:12.5g样品中碳酸钙的质量为X
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
X 4.4g ………………(2分)
100/44=X/4.4g ………………(1分)
X=10g ………………(1分)
样品中CaCO3%=10g÷12.5g×100% = 80% ………………(2分)
答:略。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目