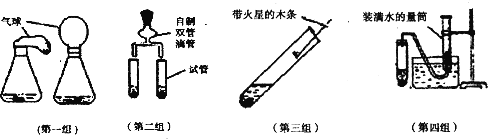
题目内容
【题目】将碳酸钠和氯化钠的混合物33.8g放入125g稀盐酸中,恰好完全反应,得溶液150g(不饱和).求:
(1)原混合物中碳酸钠的质量是多少?_____
(2)反应前盐酸中溶质的质量分数是多少?_____
(3)反应后所得溶液中溶质的质量分数是多少?_____.
【答案】21.2g11.68%24%
【解析】
混合物中的碳酸钠能与稀盐酸反应,氯化钠不与稀盐酸反应,反应后减少的质量是生成二氧化碳的质量,然后根据反应的化学方程式及提供的数据可进行相关方面的计算。
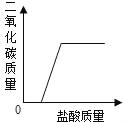
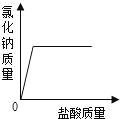
混合物中的碳酸钠能与稀盐酸反应,氯化钠不与稀盐酸反应,反应后减少的质量是生成二氧化碳的质量。(1)根据题意,生成二氧化碳的质量为:33.8g+125g-150g=8.8g。
设原混合物中碳酸钠的质量是x。
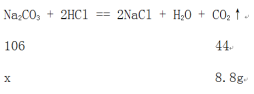
![]() =
=![]() ,解得x=21.2g
,解得x=21.2g
(2)设反应前盐酸中溶质的质量分数是y。
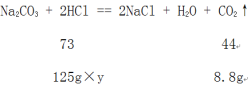
![]() =
=![]() ,解得y=11.68%
,解得y=11.68%
(3)设反应后所得溶液中溶质的质量为z。
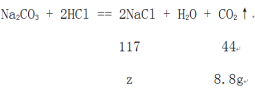
![]() =
=![]() ,解得z=23.4g
,解得z=23.4g
原混合物中氯化钠的质量为:33.8g-21.2g=12.6g
反应后所得溶液中溶质的质量为:23.4g+12.6g=36g
反应后所得溶液中溶质的质量分数为:![]() ×100%=24%
×100%=24%

【题目】某课外小组的同学将玻璃罩内充满纯净的二氧化碳气体,如图A所示,在光照充足的条件下,经过一段时间后,该小组同学用注射器从a处抽取气体,测定玻璃罩内气体的成分及其含量。

(查阅资料)
①植物通过光合作用吸收二氧化碳气体,放出氧气。
②氢氧化钠(NaOH)和氢氧化钙性质相似,其水溶液也能和二氧化碳发生反应,且没有沉淀和气体物质生成。
(实验一)检验玻璃罩内是否含有二氧化碳气体?
实验步骤 | 实验现象 | 实验结论 |
抽取适量气体,注入________中 | ____________ | 玻璃罩内含有二氧化碳 |
将上述表格中的实验步骤和现象补充完整。
(实验二)采用两种方法测定玻璃罩内气体中氧气的含量.
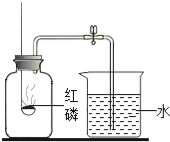
方法1:用如图B所示的装置测量气体中氧气的含量.
(1)实验前要对该装置的气密性进行检查,小明设计了一种方法,请你帮助他完成:打开止水夹,把导管末端浸没在水中,_____________,则装置气密性良好;
(2)将抽取出的气体用排水法收集到150mL的集气瓶中,关闭止水夹,点燃红磷;
(3)待装置冷却到室温后,打开止水夹,烧杯中的液体进入集气瓶中,体积约为125mL.该方法所测得氧气占气体总体积的__________%.
方法2:用如图C所示的装置测量气体中氧气的含量.
(1)抽取150mL的气体,缓缓地从b处通入装置中;
(2)实验结束后,c处气体的化学式为__________,集气瓶中排出液体的体积约为75mL.该方法所测得氧气约占气体总体积的__________%.
(实验反思)通过对比,该小组同学发现,两种方法所得实验结果差距较大,其中实验结果更准确的是__________(填写“方法1”或“方法2”),另一实验方法中不合理的实验操作是__________.(友情提示:请注明是哪种方法)。