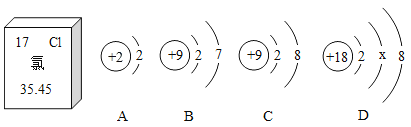题目内容
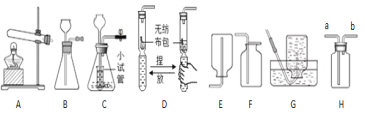
【题目】南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源.从海水中制备纯碱和金属镁的流程如图所示:
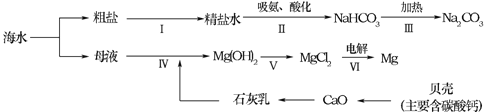
回答下列问题:
①步骤Ⅴ中所加试剂是_________.
②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,可加入下了物质,利用过滤等操作进行除杂,则加入下列三种物质的先后顺序为_______(填字序号).
a.适量的盐酸 b.稍过量的Na2CO3溶液 c.稍过量的Ba(OH)2溶液
③第VI歩反应的化学方程式是_________.
【答案】稀盐酸 cba MgCl2 ![]() Mg+Cl2↑
Mg+Cl2↑
【解析】
根据已有的物质的性质以及物质提纯的知识进行分析解答即可。
①步骤Ⅴ中是氢氧化镁转化为氯化镁,氢氧化镁与盐酸反应生成氯化镁和水,所加试剂是稀盐酸;
②粗盐水中主要含有CaCl2、MgSO4等可溶性杂质,氯化钙与碳酸钠反应生成碳酸钙和氯化钠,除去氯化钙可以加入碳酸钠溶液,硫酸镁与氢氧化钡反应生成氢氧化镁和硫酸钡,除去硫酸镁可以加入氢氧化钡溶液,题中加入碳酸钠溶液、氢氧化钡溶液均为过量的,碳酸钠与氢氧化钡反应生成碳酸钡和氢氧化钠,过量的氢氧化钡可用碳酸钠除去,所以碳酸钠应该加在氢氧化钡的后面,盐酸能与碳酸钠、氢氧化钠反应生成氯化钠,盐酸最后加入,则加入下列三种物质的先后顺序为cba;
③第 VI歩反应是电解氯化镁生成镁和氯气,化学方程式是 MgCl2 ![]() Mg+Cl2↑。
Mg+Cl2↑。

 阅读快车系列答案
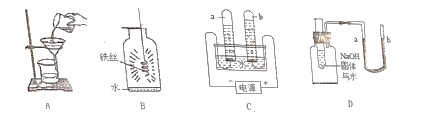
阅读快车系列答案【题目】某同学利用如图装置进行两个实验.(资料:白磷的着火点为40℃.)
Ⅰ中药品 | Ⅱ中药品 | Ⅲ中药品 | |
实验1 | 块状大理石、浓盐酸 | 硝酸银溶液 | 紫色石蕊溶液 |
实验2 | MnO2、H2O2溶液 | 白磷 热水(80℃) | 白磷 冷水(10℃) |
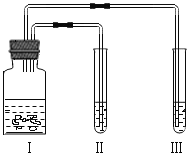
下列说法不正确的是
A. 实验1,可观察到Ⅱ中硝酸银溶液变浑浊,能说明浓盐酸有挥发性
B. 实验1,可观察到Ⅲ中的紫色石蕊溶液变红,能说明CO2能与水反应生成碳酸
C. 实验2,装置Ⅱ、Ⅲ中均有气泡产生,试管Ⅱ中的白磷发生燃烧
D. 实验2,通过对实验过程的观察分析,能证明可燃物燃烧需要有氧气和温度达到着火点
【题目】请从A或两题中任选1个作答,若两题均作答,按A计分。
A | B |
钙咀嚼片 规格:每片含碳酸钙750mg (相当于钙300mg) 用量:每次2片,每天1-2次 钙咀嚼片 规格:每片含碳酸钙750mg (相当于钙300mg) 用量:每次2片,每天1-2次 | 补铁缓释片 规格:每片含硫酸亚铁456mg 用量:成人一天一片 补铁缓释片 规格:每片含硫酸亚铁456mg 用量:成人一天一片 |
(1)碳酸钙的化学式为__________。 (2)每片钙片中钙300mg,请用计算式表示其计算过程____________________。 | (1)硫酸亚铁的化学工为__________。 (2)某成人按此说明书服药1天,可补充铁元素__________mg。 |