题目内容
【题目】最近媒体报道油炸含有淀粉的食品会产生有毒的丙烯酰胺化学式为【C3H5NO】,食用后有害健康.试计算 (可以只写出答案):
(1)丙烯酰胺的相对分子质量是多少?
(2)丙烯酰胺中各元素的质量比(C:H:N:O)是多少?
(3)丙烯酰胺中碳元素的质量分数是多少?(计算结果精确至整数部分)
(4)71g丙烯酰胺与多少克 CO2中所含碳元素的质量相等?
【答案】
(1)解:丙烯酰胺的相对分子质量是12×3+1×5+16+14=71
(2)解:丙烯酰胺中碳元素、氢元素、氮元素、氧元素的质量比=(12×3):(1×5):14:16=36:5:14:16
(3)解:丙烯酰胺中碳元素的质量分数是 ![]() ×100%≈50.7%
×100%≈50.7%
(4)解:71g丙烯酰胺含碳元素的质量是71g× ![]() ×100%=36g.
×100%=36g.
故二氧化碳的质量为: ![]() 132g
132g
【解析】(1)根据相对分子质量为构成分子的各原子的相对原子质量之和,进行分析解答.(2)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.(3)根据化合物中元素的质量分数= ![]() ×100%,进行分析解答.(4)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.
×100%,进行分析解答.(4)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答.

【题目】甲乙两化学兴趣小组的同学按课本上的实验装置做“测定空气中氧气的体积分数”实验(如图甲所示),但测出的氧气的体积分数存在误差.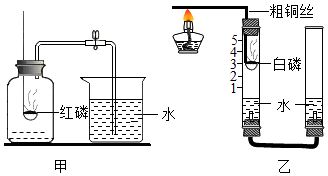
请你参与探究:
甲组测出氧气的体积分数小于五分之一
【提出问题】造成误差的原因是什么?如何改进课本上的实验装置?
【查阅资料】红磷、白磷的一些性质如下表:
颜色、状态 | 熔点/℃ | 着火点/℃ | 密度(g/cm3) | |
红磷 | 暗红色固体 | 590 | 240 | 2.34 |
白磷 | 白色或黄色固体 | 44.1 | 40 | 1.82 |
(1)【猜想与假设】A同学:可能是导管内原含有空气,后来留有吸入的水,影响实验的准确性.
B同学:可能是瓶内残留气体中还有氧气.
你还能作出的猜想是 .
(2)【交流与讨论】①他们对课本上的实验装置进行了图乙所示的改进(其他仪器忽略).
与课本上的实验装置相比较,该装置的一个优点是 .
②能得出空气中氧气约占五分之一体积的实验现象是 .
乙组同学从课本镁条燃烧实验得到启发,用镁代替红磷,实验完毕,冷却后进入水的体积远大于总容积的1/5.
(3)【猜想与假设】可能镁条与氮气发生了反应
【设计实验】为检验镁条能否在N2中燃烧,兴趣小组展开如下探究: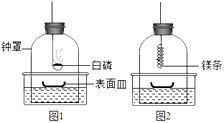
①组装仪器(图1,钟罩下端无底),检查气密性:向水槽中加水,观察到现象,说明气密性良好;
②将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞;
③待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
④打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2),观察液面变化;
【交流讨论】
a.步骤①气密性良好的现象是;
b.步骤②目的是;
c.步骤④观察到现象,说明镁条与氮气反应.
(4)【反思】乙组小罗同学认为只进行图2实验,当钟罩内进入水的体积大于总容积的 ![]() ,就能说明镁与氧气、氮气都发生了反应,对此观点你认为是否正确并说明理由 .
,就能说明镁与氧气、氮气都发生了反应,对此观点你认为是否正确并说明理由 .
(5)【拓展】①镁与氮气反应生成氮化镁(Mg3N2),由于氧气比氮气活泼,所以镁燃烧生成的氮化镁质量比氧化镁(大、小).
②8g镁在空气中燃烧,若有30%的镁生成氮化镁,计算氮化镁的质量 (写出计算过程).