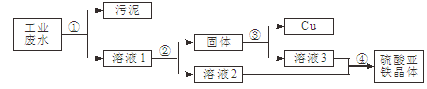
ĢāÄæÄŚČŻ
£Ø7·Ö£©ÓŠŅ»°ü°×É«·ŪÄ©£¬æÉÄÜŗ¬ÓŠBa(OH)2”¢KNO3”¢FeCl3”¢Na2CO3”¢Na2SO4ÖŠµÄŅ»ÖÖ»ņ¼øÖÖ”£ĪŖĮĖČ·¶ØĘä³É·Ö£¬½ųŠŠČēĻĀŹµŃé£ŗ
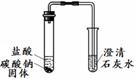
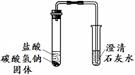
¢ŁČ”Ņ»¶ØĮæµÄ°×É«·ŪÄ©¼ÓČė×ćĮæµÄĖ®£¬Õńµ“£¬¾²ÖĆ£¬µĆ°×É«³Įµķ£¬ÉĻ²ćĒåŅŗĪŖĪŽÉ«”£
¢Ś¹żĀĖ£¬ŌŚ°×É«³ĮµķÖŠ¼ÓČė×ćĮæĻ”ŃĪĖį£¬°×É«³ĮµķČ«²æČܽā£¬ĒŅÓŠĘųÅŻ²śÉś”£
£Ø1£©¾Ż“ĖĶʶĻ£¬øĆ°×É«·ŪÄ©ÖŠŅ»¶Øŗ¬ÓŠ £»æÉÄÜŗ¬ÓŠ £»Ņ»¶Ø²»ŗ¬ÓŠ ”£
£Ø2£©Š“³ö²½Öč¢ŚÖŠ·¢Éś·“Ó¦µÄµÄ»Æѧ·½³ĢŹ½£ŗ ”£
¢ŁČ”Ņ»¶ØĮæµÄ°×É«·ŪÄ©¼ÓČė×ćĮæµÄĖ®£¬Õńµ“£¬¾²ÖĆ£¬µĆ°×É«³Įµķ£¬ÉĻ²ćĒåŅŗĪŖĪŽÉ«”£
¢Ś¹żĀĖ£¬ŌŚ°×É«³ĮµķÖŠ¼ÓČė×ćĮæĻ”ŃĪĖį£¬°×É«³ĮµķČ«²æČܽā£¬ĒŅÓŠĘųÅŻ²śÉś”£
£Ø1£©¾Ż“ĖĶʶĻ£¬øĆ°×É«·ŪÄ©ÖŠŅ»¶Øŗ¬ÓŠ £»æÉÄÜŗ¬ÓŠ £»Ņ»¶Ø²»ŗ¬ÓŠ ”£
£Ø2£©Š“³ö²½Öč¢ŚÖŠ·¢Éś·“Ó¦µÄµÄ»Æѧ·½³ĢŹ½£ŗ ”£
£Ø1£©Na2CO3ŗĶBa£ØOH£©2 NaSO4ŗĶFeCl3 KNO3 BaCO3+2HCl=BaCl2+H2O+CO2”ü
ŹŌĢā·ÖĪö£ŗÓÉ¢ŁČ”Ņ»¶ØĮæµÄ°×É«·ŪÄ©¼ÓČė×ćĮæµÄĖ®£¬Õńµ“£¬¾²ÖĆ£¬µĆ°×É«³Įµķ£¬ÉĻ²ćĒåŅŗĪŖĪŽÉ«£®æÉÖŖ¹ĢĢåÖŠ²»æÉÄÜŗ¬ÓŠĀČ»ÆĢś£ØĀČ»ÆĢśµÄČÜŅŗĪŖ»ĘÉ«£¬ÓėĘäĖüĪļÖŹ¼ä·“Ӧɜ³ÉµÄ³ĮµķŅ²ŹĒÓŠÉ«µÄ³Įµķ£©£¬ÄÜÉś³É°×É«³ĮµķŌņ¹ĢĢåÖŠŅ»¶Øŗ¬ÓŠĒāŃõ»Æ±µ£ØĒāŃõ»Æ±µÄÜÓėĢ¼ĖįÄĘ»ņĮņĖįÄĘ·“Ӧɜ³É°×É«³Įµķ£©£»
ÓÉ¢Ś¹żĀĖ£¬ŌŚ°×É«³ĮµķÖŠ¼ÓČė×ćĮæĻ”ŃĪĖį£¬°×É«³ĮµķČ«²æČܽā£¬ĒŅÓŠĘųÅŻ²śÉś£®ŌņøĆ³ĮµķŹĒĢ¼ĖįŃĪµÄ³Įµķ£¬ĖłŅŌøĆ¹ĢĢåÖŠŅ»¶Øŗ¬ÓŠĢ¼ĖįÄĘ£¬Ņ»¶Ø²»ŗ¬ĮņĖįÄĘ£»
£Ø1£©ÓÉ·ÖĪöÖŖøĆ°×É«·ŪÄ©ÖŠŅ»¶Øŗ¬ÓŠĒāŃõ»Æ±µ”¢Ģ¼ĖįÄĘ£¬æÉÄÜŗ¬ÓŠĻõĖį¼Ų£¬Ņ»¶Ø²»ŗ¬ĮņĖįÄĘŗĶĀČ»ÆĢś£»
£Ø2£©²½Öč¢ŚÖŠµÄ·“Ó¦ŹĒĢ¼Ėį±µŗĶĻ”ŃĪĖįµÄ·“Ó¦£¬·½³ĢŹ½ĪŖ£ŗBaCO3+2HClØTBaCl2+CO2”ü+H2O£®

Į·Ļ°²įĻµĮŠ“š°ø
 ÖŠæ¼½ā¶Įæ¼µć¾«Į·ĻµĮŠ“š°ø
ÖŠæ¼½ā¶Įæ¼µć¾«Į·ĻµĮŠ“š°ø
Ļą¹ŲĢāÄæ