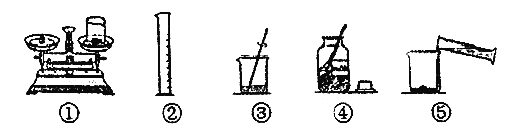
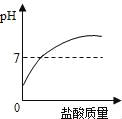
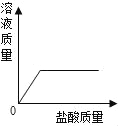
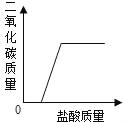
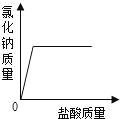
题目内容
【题目】某学生设计用高锰酸钾为原料制取氧气的实验装置(如图),回答下列问题
(1)写出图中仪器的名称:
a________________ b____________________c_______________;
(2)写出图中存在的3处错误.
①________________________________
②_________________________________
③__________________________________
(3)制取氧气前,必须先检查装置_____;收集氧气可以用_____法和_____法.试管口塞棉花团的作用是_____;在结束实验时,_____________,其目的是________.
(4)写出实验室用氯酸钾制备氧气的文字表达式:________________

【答案】酒精灯;试管; 铁架台; 试管口高于试管底部; 试管中导管伸的太长; 试管口未放棉花; 气密性; 向上排空气;排水;防止高锰酸钾随气流进入导气管;将导管从水槽中移出;防止水倒吸引起试管炸裂;氯酸钾 ![]() 氯化钾+氧气;
氯化钾+氧气;
【解析】
(1)根据常用仪器回答;
(2)根据高锰酸钾制取氧气的装置和实验注意事项分析解答;
(3)根据制取氧气的实验步骤分析解答;
(4)根据氯酸钾制取氧气的反应原理书写表达式。
(1)图中仪器分别是:酒精灯、试管、铁架台;
(2)观察图示可知:装置中存在的错误是:试管口高于试管底部,会引起冷凝水倒流造成试管炸裂;试管中导管太长,不利于氧气导出;试管口未放棉花,加热时高锰酸钾粉末会进入导管;
(3)为防止装置漏气收集不到气体,制取氧气前,必须先检查装置气密性;氧气的密度比空气大,所以可用向上排空气法收集;氧气不易溶于水,还可用排水法收集;试管口塞棉花团的作用是防止高锰酸钾随气流进入导气管;实验结束时,先将导管移出,再熄灭酒精灯,以防止水倒吸引起试管炸裂;
(4)氯酸钾在二氧化锰的催化作用下受热分解生成氧气和氯化钾,文字表达式为:氯酸钾 ![]() 氯化钾+氧气。
氯化钾+氧气。

 科学实验活动册系列答案
科学实验活动册系列答案【题目】金属用途广泛,其结构和性质等是化学的重要研究内容.
![]() 如图
如图![]() 是铝的原子结构示意图.下列说法不正确的是________
是铝的原子结构示意图.下列说法不正确的是________
A.铝原子的质子数为![]()
B.在化合物中铝通常显![]() 价
价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
![]() 某化学小组用一定量的
某化学小组用一定量的![]() 和
和![]() 混合溶液进行了如图
混合溶液进行了如图![]() 实验,并对溶液
实验,并对溶液![]() 和固体
和固体![]() 的成分进行了分析和研究.
的成分进行了分析和研究.
(提出问题)溶液![]() 中的溶质可能有哪些?
中的溶质可能有哪些?
(做出猜想)①只有![]() ②
②![]() 、
、![]()
③![]() 、
、![]() ④
④![]() 、
、![]() 、
、![]()
(交流讨论)不合理的猜想是________(填标号),其理由是________.
(实验探究)若猜想①成立,通过以下实验可确定固体![]() 的成分,请将下表填写完整.
的成分,请将下表填写完整.
实验步骤 | 现象 | 有关反应的化学方程式 |
取少量固体 | 有气泡产生 | ________ |
![]() 如图
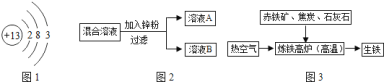
如图![]() 是工业炼铁示意图.其中,焦炭的作用是燃烧提供能量和________;
是工业炼铁示意图.其中,焦炭的作用是燃烧提供能量和________;
![]() 有铁生成的化学方程式为________.
有铁生成的化学方程式为________.
![]() 称取
称取![]() 石灰石(主要成分是
石灰石(主要成分是![]() ,杂质不参与反应)放入烧杯中,向其中加入
,杂质不参与反应)放入烧杯中,向其中加入![]() 稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为
稀盐酸,二者恰好完全反应.反应结束后称量烧杯中剩余物质的总质量为![]() (包括烧杯的质量,且气体的溶解度忽略不计).试计算石灰石中杂质的质量分数_________.
(包括烧杯的质量,且气体的溶解度忽略不计).试计算石灰石中杂质的质量分数_________.
【题目】某实验小组的同学为了测定实验室中氯酸钾(KClO3)样品的纯度,取一定量该样品与1g二氧化锰混合,其总质量为6g,依次加热该混合物T1、T2、T3、T4时间后,分别冷却称量剩余固体质量,记录的有关数据如表
(样品中的杂质不参与化学反应:有关方程式: 2KClO3 ![]() 2KCl+3O2↑)
2KCl+3O2↑)
加热时间 | T1 | T2 | T3 | T4 |
剩余固体质量/g | 4.24 | 4.16 | 4.08 | 4.08 |
(1)氯酸钾中钾、氯、氧元素的质量比为______;
(2)完全反应后产生氧气的总质量为______;
(3)计算氯酸钾样品中氯酸钾的质量分数_______.(写出计算过程)
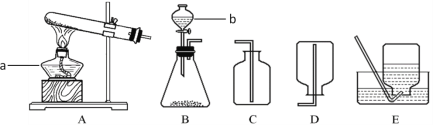
【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的过程:
【假设】H2O2生成O2的快慢与催化剂种类有关。
【实验方案】常温下,在两瓶同质量、同浓度的H2O2溶液中,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
【进行实验】右下图是他们进行实验的装置图,气体发生装置中A仪器的名称是_____________,此实验中B处宜采用的气体收集方法是_______ _____。
【实验记录】
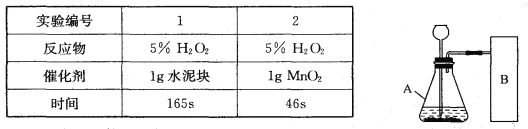
【结论】该探究过程得出的结论是_________________________。
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快。若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的_____ _____是否改变。
【实验拓展】H2O2生成O2的快慢还与哪些因素有关?研究性学习小组进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
取一支试管加入3mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | |
另取一支试管加入3mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
请你设计:
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
实验步骤 | 现 象 | 结 论 |
温度越高,过氧化氢分解的速率越大 |