题目内容
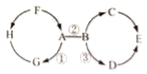
【题目】A、B、C三种物质的溶解度曲线如图所示,下列分析正确的是(____)
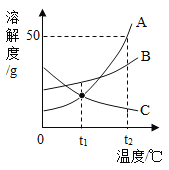
A t1℃时,A、C两物质的饱和溶液中溶质的质量相等
B t2℃时,把A、B、C三种物质的饱和溶液降温至t1℃;所得溶液的溶质质量分数大小关系是B>C=A
C t2℃时,把40gA放入50g水中能得到A的饱和溶液,其中溶质和溶液的质量比为1:3
D 若B中含有少量A,要提纯B,可采用_____的方法
【答案】C 蒸发结晶
【解析】
A、不知饱和溶液质量大小,无法判断所含溶质质量多少,故错误;
B、饱和溶液中溶质的质量分数=![]() ×100%,可知溶解度大则溶质的质量分数大;t2℃时,把A、B、C三种物质的饱和溶液降温至t1℃,AB溶解度减小析出晶体,溶质的质量分数减小,C溶解度变大,溶液中溶质、溶剂的质量不变,与降温前相等,而t1℃时B的溶解度大于A的溶解度大于降温前C的溶解度;故所得溶液的溶质质量分数大小关系是B>C>A,故错误;
×100%,可知溶解度大则溶质的质量分数大;t2℃时,把A、B、C三种物质的饱和溶液降温至t1℃,AB溶解度减小析出晶体,溶质的质量分数减小,C溶解度变大,溶液中溶质、溶剂的质量不变,与降温前相等,而t1℃时B的溶解度大于A的溶解度大于降温前C的溶解度;故所得溶液的溶质质量分数大小关系是B>C>A,故错误;
C、溶液具有均一性,所以一定温度下物质的饱和溶液其溶质的质量分数是相同的; t2℃时A的溶解度是50g,即100g水中最多溶解50g的A,所以把40gA放入50g水中最多溶解25g,能得到A的饱和溶液,其中溶质和溶液的质量比为25g:75g=1:3,正确;
D、A的溶解度受温度影响较大,B的溶解度受温度影响较小,所以若B中含有少量A,要提纯B,可采用蒸发结晶的方法;
故答案为:C;蒸发结晶.

练习册系列答案
相关题目