题目内容
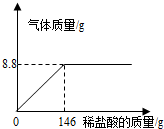
化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示。请完成下列计算内容:

(1)样品中碳酸钙的质量分数是多少?
(2)所用稀盐酸溶质的质量分数是多少?
【答案】
80%;10%
【解析】
试题分析:由题中数据和曲线图可知,当二氧化碳的质量为8.8g时,反应停止,根据二氧化碳的质量,即可计算出碳酸根的质量分数和盐酸中溶质的质量分数。
解:设样品中CaCO3的质量为x,参加反应的稀盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 73 44
x y 8.8g
= =
x =20g y =14.6g
样品中CaCO3的质量分数为:×100%=80%
稀盐酸的溶质质量分数为:×100%=10%
答:样品中CaCO3的质量分数为80%;稀盐酸的溶质质量分数为10%。
考点:根据化学方程式计算;溶液中溶质质量分数。
点评:根据化学方程式计算,要注意解题的步骤,设、写、找、列、解、答;
溶液中溶质质量分数= 。
。

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案
相关题目
 (2012?齐齐哈尔)化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:
(2012?齐齐哈尔)化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容: 化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应的进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算:
化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应的进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算:
