题目内容
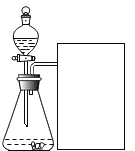
【题目】某研究小组为验证铁、铜、锌、银的金属活动性顺序,设计如图所示三个实验(三种金属均已用砂纸打磨过,其形状和大小相同,稀盐酸的浓度和用量也相同)。
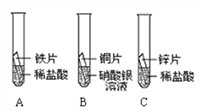
(1)一段时间后,观察到实验B的铜片表面有银白色固体附着,且溶液由无色变为______色,这说明铜比银的金属活动性______(选填“强”或“弱”),该反应的化学方程式为____________。
(2)甲同学认为通过实验A和C可比较锌和铁的金属活动性,他依据的实验现象是_________。
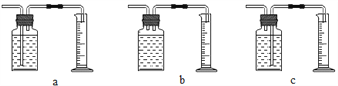
(3)乙、丙两位同学认为仅仅通过上述实验不足以得出四种金属的活动性顺序,因此在上述实验的基础上,两人分别选用不同的金属与不同的化合物溶液,各自补做了一个实验,装置均如下图所示,且都实现了探究目的。
![]()
乙同学的实验:X是金属________,丙同学的实验:Y是________溶液。
【答案】 蓝 强 Cu+2AgNO3===2Ag+Cu(NO3)2 根据反应的剧烈程度 Fe(或Cu) FeSO4溶液 (或CuSO4溶液)
【解析】(1)铜能与硝酸银反应生成硝酸铜和银,硝酸铜的溶液为蓝色,该反应的化学方程式为:Cu+2AgNO3===2Ag+Cu(NO3)2,说明铜比银的金属活动性强;(2)锌和铁都与盐酸反应,锌反应的速率比铁快,说明锌在铁的前面;(3)A能说明铁在氢的前面,B说明铜在银的前面,C说明锌在氢的前面,A、C说明锌在铁的前面,故通过A、B、C说明Zn>Fe>H,Cu>Ag,不能说明铁和铜的活动性,故可以通过金属与酸或金属与盐溶液的反应来证明铁和铜的活动性强弱。

练习册系列答案
相关题目