题目内容
武汉-宜昌高速电气化铁路2013年通车,高铁建设需要大量的铁矿石.某化学兴趣小组取得铁路建设的赤铁矿石(含Fe2O3和杂质,杂质不溶于水且不参加化学反应)20g加入84g稀盐酸,恰好完全反应后过滤,得到滤渣4g.求:(1)赤铁矿石中Fe2O3的质量分数;
(2)所得滤液中溶质的质量分数.
【答案】分析:赤铁矿与盐酸混合,铁矿中氧化铁和盐酸反应,得到氯化铁溶液,铁矿中杂质既不溶酸,也不溶于水,形成滤渣.所以,铁矿中氧化铁的质量为20g-4g=16g,利用氧化铁的质量求出生成的氯化铁的质量进而求出所得滤液中溶质的质量分数即可.
解答:解:(1)赤铁矿样品中Fe2O3的质量=20g-4g=16g;
赤铁矿样品中Fe2O3的质量分数(纯度)=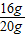 ×100%=80%.
×100%=80%.
(2)设反应后生成氯化铁的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 325
16g x
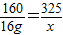
解之得 x=32.5g
反应后所得溶液质量=20g+84g-4 g=100g
反应后所得溶液中溶质的质量分数=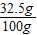 ×100%=10%
×100%=10%
答:(1)赤铁矿石中Fe2O3的质量分数为80%;
(2)所得滤液中溶质的质量分数为32.5%.
点评:反应后溶液质量可根据质量守恒进行计算:反应后溶液质量=赤铁矿质量+稀盐酸质量-滤渣质量.
解答:解:(1)赤铁矿样品中Fe2O3的质量=20g-4g=16g;
赤铁矿样品中Fe2O3的质量分数(纯度)=
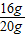 ×100%=80%.
×100%=80%.(2)设反应后生成氯化铁的质量为x
Fe2O3+6HCl=2FeCl3+3H2O
160 325
16g x
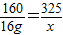
解之得 x=32.5g
反应后所得溶液质量=20g+84g-4 g=100g
反应后所得溶液中溶质的质量分数=
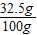 ×100%=10%
×100%=10%答:(1)赤铁矿石中Fe2O3的质量分数为80%;
(2)所得滤液中溶质的质量分数为32.5%.
点评:反应后溶液质量可根据质量守恒进行计算:反应后溶液质量=赤铁矿质量+稀盐酸质量-滤渣质量.

练习册系列答案
相关题目