题目内容
【题目】对于学习中遇到的无现象一类的化学反应,应多多思考创设情境使现象外显,证明反应的发生。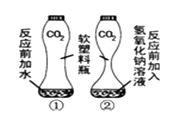
(1)对于反应:2NaOH + CO2 = Na2CO3 + H2O,若从反应物的消耗(二氧化碳的消耗)考虑证明反应的发生,可设计如右图实验,图①的作用是 , 证明CO2 与NaOH溶液中的溶质确实发生了反应,现象是;或从生成物的产生角度(检验碳酸钠)证明反应的发生,设计实验,方案是(用简洁的文字简要叙述),现象是 _,请写出该反应的化学方程式。
(2)对于反应:HCl+NaOH=NaCl+H2O,下列证明反应发生的方法可行的是。(可多选)
A.测定反应前后溶液的酸碱度
B.测定反应前后的温度
C.用硝酸银检验产物氯化钠的存在
D.比较反应前后物质的总质量
【答案】
(1)对比,排除水的干扰,与氢氧化钠反应的瓶子变形更大,在反应后的溶液中滴加足量稀盐酸,产生气泡,2Na2CO3+2HCl=2NaCl+CO2↑+H2O
(2)A,B
【解析】(1). 氢氧化钠溶液中有氢氧化钠和水两种物质,为证明二氧化碳是被氢氧化钠反应掉,所以用图①实验进行对比,排除水的干扰 ; 与氢氧化钠反应的瓶子变瘪,变形严重,盛水的瓶子变形比较小,证明二氧化碳是被氢氧化钠反应掉; 氢氧化钠和碳酸钠的混合物中加入盐酸时,盐酸先与氢氧化钠反应,所以证明碳酸钠时,在反应后的溶液中要滴加足量稀盐酸 如能看到 产生气泡,反应方程式为2Na2CO3+2HCl=2NaCl+CO2↑+H2O
(2)向氢氧化钠溶液中加盐酸时,溶液的性质由碱性变至中性,酸过量时,呈酸性,pH变化是由大于7逐渐减小,酸过量时pH大于7,测定反应前后溶液的酸碱度,可证明二者反应了;中和反应放热,测定反应前后的温度,可证明二者能反应;盐酸和氯化钠都能与硝酸银生成白色沉淀,所以不能用硝酸银检验产物氯化钠;据质量守恒定律可知,反应前后物质的总质量不变,不能比较反应前后物质的总质量来验证反应的发生。
所以答案是:对比、排除水的干扰,与氢氧化钠反应的瓶子变形更大、在反应后的溶液中滴加足量稀盐酸、产生气泡、2Na2CO3+2HCl=2NaCl+CO2↑+H2O;AB。
【考点精析】根据题目的已知条件,利用二氧化碳的化学性质的相关知识可以得到问题的答案,需要掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应.

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案