题目内容
【题目】生活中处处有化学,请用所学知识回答下列问题:
(1)明矾可用于净水,是因为明矾溶于水生成的胶状物可以___悬浮于水中的杂质,使之从水中沉降出来,日常生活中常用___的方法降低水的硬度。
(2)甲醛(CH3OH)有毒,误饮可使眼睛失明,甚至死亡,最新研究证明,用氨气(NH3)处理含有甲醛的工业废水,可使其转变成无毒的物质,有关反应的化学方程式为5CH3OH+12O2+6NH3═3X+5CO2+19H2O,则X的化学式为___。
(3)丙烷(C3H8)是家用液化石油气的主要成分之一,它和甲烷在空气中燃烧生成物相同,请写出丙烷燃烧的化学方程式___。
(4)鉴别黄铜和黄金有多种方法,用灼烧法鉴别产生的现象及结论是___。
【答案】吸附 加热煮沸 N2 C3H8+5O2![]() 3CO2+4H2O 将样品灼烧,表面变黑色的是黄铜,不变色的是黄金
3CO2+4H2O 将样品灼烧,表面变黑色的是黄铜,不变色的是黄金
【解析】
(1)明矾可用于净水,是因为明矾溶于水生成的胶状物具有吸附性,可以吸附悬浮于水中的杂质,使之从水中沉降出来;由于加热煮沸能减少水中钙、镁化合物的含量,日常生活中常用加热煮沸的方法降低水的硬度;
(2)在5CH3OH+12O2+6NH3=3X+5CO2+19H2O中,反应前含有5个C原子,38个H原子,29个O原子,6个N原子,反应后含有5个C原子,38个H原子,29个O原子,3个X分子,故一个X分子中含有2个氮原子,其化学式为N2;
(3)由于甲烷在空气中燃烧生成了二氧化碳和水,丙烷和甲烷在空气中燃烧的生成物相同,所以丙烷燃烧的化学方程式是:C3H8+5O2![]() 3CO2+4H2O;
3CO2+4H2O;
(4)由于铜在加热时能与氧气反应生成了黑色的氧化铜,金的性质稳定灼烧时也不与氧气反应,所以鉴别黄铜和黄金用灼烧法,鉴别产生的现象及结论是:将样品灼烧,表面变黑色的是黄铜,不变色的是黄金。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案【题目】学习了二氧化锰对过氧化氢分解有催化作用的知识后,某兴趣小组的同学提出问题:氧化铁能否起到类似于二氧化锰的催化作用呢?于是他们进行了以下探究:
(猜想)
Ⅰ.氧化铁不是反应的催化剂、也不参与反应,质量和化学性质反应前后均不变;
Ⅱ.氧化铁参与反应产生氧气,反应前后质量不变,但化学性质发生了改变;
Ⅲ.氧化铁是反应的催化剂,反应前后_____。
(实验)用天平称0.2g氧化铁,用试管取5mL 5%的过氧化氢溶液,进行如图实验:
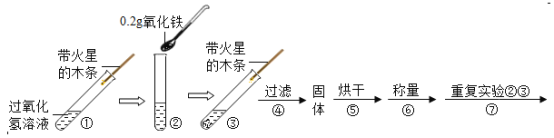
(注:氧化铁不溶于水,过滤可与水分离)
(1)填写如表:
步骤3现象 | 步骤6结果 | 步骤7现象 | 结论 |
带火星的木条复燃 | _____ | 过氧化氢溶液中,_____ | 猜想1、Ⅱ不成立, 猜想Ⅲ成立 |
(2)步骤①的目的是_____。
(3)步骤⑦重复实验②、③目的是_____。
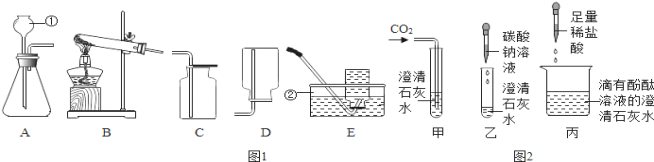
【题目】石家庄28中化学兴趣小组的同学在学习九年级《化学》下册中的资料卡片“石笋和钟乳石的形成”时,发现难溶于水的碳酸钙当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2,联想到实验室中澄清石灰水与二氧化碳反应会生成碳酸钙:Ca(OH)2+CO2=CaCO3↓+H2O,对长时间向碱溶液中通入CO2反应后溶液中的溶质组成产生了浓厚的兴趣。
(提出问题)一定量CO2与NaOH溶液反应后的溶质组成是什么?
(查阅资料)(1)通入少量CO2反应的化学方程式为:___。
(2)通入过量CO2,反应的化学方程式为:Na2CO3+CO2+H2O=2NaHCO3。
(3)碳酸氢盐都是可溶于水的,BaCO3难溶于水。
(4)碳酸氢钠溶液呈碱性。
(提出猜想)(1)溶质为NaOH和Na2CO3; (2)溶质为Na2CO3;(3)溶质为___(填化学式);(4)溶质为NaHCO3。
(设计实验)
实验步骤 | 实验现象 | 实验结论 |
(1)用玻璃棒蘸取反应后溶液,滴在pH试纸上 | pH=9 | 该溶液显碱性 |
(2)取反应后溶液少许于试管中,向其中滴加过 量的___溶液 | 有___生成 | 猜想(4)不成立 |
(3)取步骤(2)中的上层清液,滴入稀盐酸 | 有气泡冒出 | 猜想(1)和(2) 不成立 |
(得出结论)猜想(3)成立。
(讨论交流)(1)有同学提出,实验步骤(1)是多余的,你认为该实验设计是否需要,___(填“需要”或“不需要”)。
(2)同学们又一次把目光投向了教材,发现遇热或压强变小时:Ca(HCO3)2=CaCO3↓+CO2↑+H2O,纷纷提出,干粉灭火器中用NaHCO3灭火的反应原理与之相似,试写出NaHCO3受热分解的化学方程式:__。
(反思应用)同学们回忆起实验室检验二氧化碳的情景,心想:如果向澄清石灰水中不断通入二氧化碳,会看到怎样的现象呢?请你描述一下:___。