题目内容
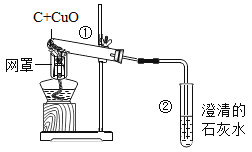
【题目】某工厂丢弃的废铜屑(其中混有少量铁屑),活动小组的同学欲利用其制取胆矾晶体,他们设计了下面的两种制取流程。已知:
①Cu+Fe2(SO4)3=CuSO4+2FeSO4
②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
③2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2H2O;请回答:
2CuSO4+2H2O;请回答:
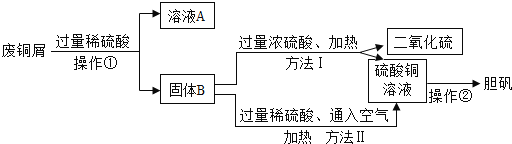
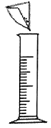
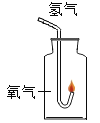
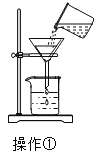
(1)该小组同学用如图所示装置进行操作①,请指出操作中存在的两处错误:错误1____________,错误2_____________________ ;
(2)溶液A的溶质有______(写化学式),铁与稀硫酸反应的化学方程式为______。
(3)两种方法比较,符合绿色化学要求的是方法______(填“Ⅰ”或“Ⅱ”)。
(4)用100克98%的浓硫酸配制49%的稀硫酸的方法为______。
【答案】未用玻璃棒引流 漏斗下端管口未紧靠烧杯内壁 FeSO4、H2SO4 Fe+H2SO4=FeSO4+H2↑ Ⅱ 先计算需要加水的量为100mL,然后取水于烧杯中,将100g98%的浓硫酸缓缓地沿器壁慢慢注入100mL水中,并用玻璃棒不断搅拌,冷却后装瓶储存
【解析】
(1)通过分析过滤操作的装置可知,未用玻璃棒引流,故填未用玻璃棒引流;漏斗下端管口未紧靠烧杯内壁,故填漏斗下端管口未紧靠烧杯内壁;
(2)铁和硫酸反应生成硫酸亚铁和氢气,且稀硫酸过量,溶液A的溶质有FeSO4、H2SO4,故填FeSO4、H2SO4;化学方程式故填Fe+H2SO4=FeSO4+H2↑;
(3)方法Ⅰ中产生的二氧化硫有毒,会污染空气,符合绿色化学要求的是方法Ⅱ,故填Ⅱ;
(4)浓溶液配置稀溶液时,第一步先计算需要加水的量,加水的质量![]() -100g=100g,换算成水的体积是100mL的水,第二步是量取,用量筒和胶头滴管量取100mL水于烧杯中,第三步是溶解,将100g98%的浓硫酸缓缓地沿器壁慢慢注入100mL水中,并用玻璃棒不断搅拌,最后装瓶储存,故填先计算需要加水的量为100mL,然后取水于烧杯中,将100g98%的浓硫酸缓缓地沿器壁慢慢注入100mL水中,并用玻璃棒不断搅拌,冷却后装瓶储存。
-100g=100g,换算成水的体积是100mL的水,第二步是量取,用量筒和胶头滴管量取100mL水于烧杯中,第三步是溶解,将100g98%的浓硫酸缓缓地沿器壁慢慢注入100mL水中,并用玻璃棒不断搅拌,最后装瓶储存,故填先计算需要加水的量为100mL,然后取水于烧杯中,将100g98%的浓硫酸缓缓地沿器壁慢慢注入100mL水中,并用玻璃棒不断搅拌,冷却后装瓶储存。

 口算能手系列答案
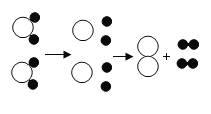
口算能手系列答案【题目】宏观与微观是认识事物的两种基本角度。可以用“分”与“合”的思想设计实验证明水的组成。

实验装置图 | 微观示意图 | 实验步骤 | 实验现象 | 结论及解释 |
|
| 通直流电。 | 一段时间后,试管a 中气体的体积约为试管 b 中气体的体积的_____倍。 | 水由_____元素组成。 水 分 子 中氢、氧原子的个数比为_____ 。 |
切断电源,取出试管。将燃着的木条伸入试管 a 中; 用带火星的木条伸 入试管 b 中。 | 试管 a 中的气体能燃烧,产生淡蓝色火焰; 试管 b 中的气体使带火星的木条_____。 | |||
|
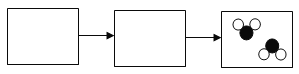
在方框中画出氢气燃烧的微观示意图。_____ | 点燃氢气,伸入充满氧气的干燥集气瓶中。 | 。_____ |