题目内容
【题目】实验室有失去标签的四瓶无色溶液,分别为Ca(OH)2、Na2CO3、稀盐酸、NaCl溶液中的一种,为鉴别它们,现将这四瓶无色溶液分别标号为A、B、C、D,某校化学兴趣小组的同学邀你一同参与:
(提出问题)A、B、C、D分别是什么溶液?
(实验药品)失去标签的四瓶溶液和无色酚酞试液。
(实验仪器)试管、胶头滴管、烧杯等。
(收集证据)
实验操作 | 实验现象 | 实验结论 |
(1)分别取A、B、C、D溶液少量于试管中,两两混合 | A、B混合产生大量气泡,C、D混合无明显现象 | A、B分别是___溶液中的一种,A与B反应的化学方程式为__________,C、D分别是_______溶液中的一种 |
(2)各取A、B、C、D溶液于四支试管中,分别滴加两滴无色酚酞试液,振荡 | A、D变红,B、C无明显现象 | A为__________溶液;C为_________溶液;D为__________溶液 |
(反思与体会)鉴别物质的关键是利用物质的特征性质。
(继续探究)将实验操作(2)实验后的四支试管中的溶液,倒入一洁净的烧杯中,充分反应静置后发现,烧杯底部有白色沉淀,上层清液为无色。则上层清液中一定含有的溶质是________(指示剂除外),可能含有的溶质是______________。为验证可能含有的溶质是否存在,应补充实验的化学方程式为__________________________。
【答案】盐酸和碳酸钠 ![]() 氢氧化钙和氯化钠 碳酸钠 氯化钠 氢氧化钙 氯化钠 氯化钙
氢氧化钙和氯化钠 碳酸钠 氯化钠 氢氧化钙 氯化钠 氯化钙 ![]()
【解析】
收集证据:(1)分别取A、B、C、D溶液少量于试管中,两两混合,碳酸钠能与稀盐酸反应生成氯化钠、二氧化碳和水,有气泡产生,故A、B分别是碳酸钠与稀盐酸中的一种,该反应的化学方程式为:![]() ;
;
氢氧化钙与氯化钠不反应,无明显现象,故C、D分别是氢氧化钙和氯化钠溶液中的一种;
(2)各取A、B、C、D溶液于四支试管中,分别滴加两滴无色酚酞试液,振荡,无色酚酞遇碱变红,在中性和酸性溶液中都不变色,碳酸钠、氢氧化钙显碱性,能使无色酚酞试液变红,稀盐酸显酸性,氯化钠显中性,不能使无色酚酞试液变红,A、D变红,B、C无明显现象,结合(1)的结论,故A为碳酸钠、C为氯化钠、D为氢氧化钙;
继续探究:将实验操作(2)实验后的四支试管中的溶液,倒入一洁净的烧杯中,充分反应静置后发现,烧杯底部有白色沉淀,上层清液为无色,将溶液混合后,氢氧化钙先与稀盐酸反应生成氯化钙和水,生成的氯化钙能与碳酸钠反应生成碳酸钙和氯化钠,该白色沉淀应为碳酸钙,有白色沉淀,说明溶液中不含盐酸,因为碳酸钙能与稀盐酸反应生成氯化钙、二氧化碳和水,两者不可能共存,上层清液为无色,说明溶液不显碱性,溶液中不含碳酸钠、氢氧化钙,由于氯化钠不参与反应,且氯化钙与碳酸钠反应生成了氯化钠,故溶液中一定含氯化钠,碳酸钠完全反应,氯化钙可能恰好和碳酸钠完全反应,也可能过量,故可能含有的溶质是氯化钙;
为验证是否含氯化钙,可取上层清液,加入碳酸钠,碳酸钠能与氯化钙反应生成碳酸钙和氯化钠,如有白色沉淀产生,说明含氯化钙,无明显现象,说明不含氯化钙,该反应的化学方程式为:![]() ,故填:氯化钠、氯化钙、
,故填:氯化钠、氯化钙、 ![]() 。
。

【题目】沪教版九年级化学下册P197有下列表述:“在金属活动性顺序中,位于氢前面的金属能与酸反应置换出氢气”。
(提出问题)小明同学在阅读课本时提出问题,稀盐酸和浓盐酸反应是否相同?位于氢前面的金属能置换浓硫酸中的氢吗?于是他和同学们一起进行了实验探究。
(实验探究1)小明同学设计了下列实验方案,并记录了实验现象:
实验 | 固体药品 | 液体药品 | 现象 |
① | 铁片5g | 5%的盐酸25mL | 有无色无味的气体产生,反应速度较慢 |
② | 铁片5g | 37%的盐酸25mL | 有无色无味的气体产生,反应速度很快 |
(1)写出实验①中反应生成的盐的化学式是_____。
(2)上述实验设计的思想方法是_____。
(3)经验证实验①和②产生的气体均为H2,由此小明同学得出位于氢前面的金属能置换出稀盐酸和浓盐酸中的氢;由上述实验还能得出的结论是_____。

(实验探究2)甲乙丙丁四位同学分别做了如上四个实验,观察现象,并进行对比。
(1)甲同学观察有气泡产生,写出反应的化学方程式_____。
(2)乙同学的实验现象说明,浓度的改变也会影响物质的_____(填“化学”或“物理”)性质。
(3)丙同学实验时发现产生气泡的速度比甲同学快,说明升高_____能使反应加快。
(4)丁同学实验时闻到有刺激性气味的气体产生。后经查阅资料和实验验证得知该气体是导致酸雨的主要物质,则该气体是_____(写化学式)。该实验说明,锌和浓硫酸在加热时能发生反应,反应类型_____(填“是”或“不是”)置换反应。
(评价反思)在探究酸的化学性质时,教材中的原话强调稀硫酸的原因是_____。
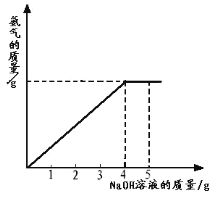
【题目】某化学兴趣小组的同学学习“灭火器原理”后,设计了如下图所示实验,并对反应后瓶中残留废液进行探究。
(提出问题)废液中所含溶质是什么?
(猜想与假设)
猜想1:废液中的溶质是NaCl、Na2CO3和HCl
猜想2:废液中的溶质只有NaCl
猜想3:废液中的溶质是NaCl、HCl
猜想4:废液中的溶质是______。
(讨论与交流)
小明认为猜想I无需验证就知道是错误的,他的理由是_____(请用化学方程式说明)。
(实验与结论)
(1)小亮同学为验证猜想3,取少量废液装入试管中,然后滴入酚酞溶液,发现溶液不变色,于是小亮认为猜想3正确。你认为他的结论____(填“正确”或“错误”),理由是______________。
请你另设计实验方案验证猜想3:
实验步骤 | 实验现象 | 实验结论 |
__________________ | __________________ | 猜想3正确 |
(2)验证猜想4,可选择的试剂有____________。
A.酚酞溶液B.氢氧化钾溶液C.稀硫酸D.氯化钡溶液
(拓展与应用)若废液中的溶质是NaCl和HCl,根据盐酸的性质,无需另加试剂,只要对废液进行____操作,即可从废液中得到NaCl固体。