题目内容
实验室里我们常用金属锌和稀硫酸反应来制取氢气,反应的化学方程式为:Zn+H2SO4═ZnSO4+H2↑.
(1)小敏想制取8g氢气,你帮她算算最少需要消耗多少克的金属锌?
(2)氢气作为燃料,越来越受到人们的关注.氢气作为燃料的优点是① ;② .
(1)小敏想制取8g氢气,你帮她算算最少需要消耗多少克的金属锌?
(2)氢气作为燃料,越来越受到人们的关注.氢气作为燃料的优点是①
分析:(1)依据方程式中锌和氢气的质量关系即可求出反应的锌的质量;
(2)从氢气燃烧时的热量多少和污染的有关方面分析解答;
(2)从氢气燃烧时的热量多少和污染的有关方面分析解答;
解答:解:(1)设最少需要消耗金属锌的质量是x
Zn+H2SO4═ZnSO4+H2↑
65 2
x 8g
=
x=260 g
(2)①完全燃烧放出的热量多;②燃烧产物是水,无污染.(写的合理就可以).
故答案为:(1)答:制取8g氢气,最少需要消耗260克的金属锌;
(2)①完全燃烧放出的热量多;②燃烧产物是水,无污染.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 8g
| 65 |
| x |
| 2 |
| 8g |
x=260 g
(2)①完全燃烧放出的热量多;②燃烧产物是水,无污染.(写的合理就可以).
故答案为:(1)答:制取8g氢气,最少需要消耗260克的金属锌;
(2)①完全燃烧放出的热量多;②燃烧产物是水,无污染.
点评:此题是根据化学方程式的计算题,该题比较简单,就是用一种生成物的质量求一种反应物的质量,属于最基本类型的计算题.

练习册系列答案
相关题目

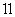
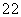 。
。
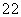 。
。