题目内容
【题目】请回答下列问题:
(1)从 Na,O,C,H,Ca五种元素中选择适当元素,写出符合下列要求的各物质的化学式:
葡萄糖的化学式_______;具有还原性的有毒气体______;常见制氧物质_______改良酸性土壤的碱________;小苏打_______;2个碳酸根离子_________
(2)现有铁、氧化铜、稀盐酸、氢氧化钠溶液、硫酸铜溶液五种物质,两两混合能发生的反应有______个。写出其中一个反应的方程式_________
(3)已知浓硝酸(HNO3)见光会发生分解反应,生成红棕色的NO2气体和一种常见液体以及能供给呼吸的气体,写出该反应的化学方程式___________;
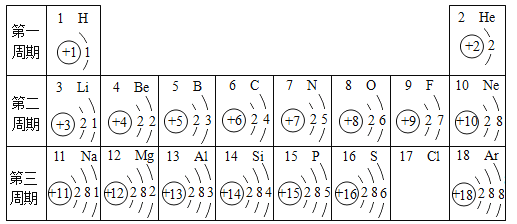
(4)某CaCl2样品中,可能含有 KNO3、CuCl2、MgCl2、NaCl 和 Na2CO3中的某些物质,取该样品m克溶于适量水中,得到澄清的无色溶液,然后向其中加入足量AgNO3溶液,得到n克白色沉淀,则该样品组成中,肯定没有的是:_______。
(5)粗盐中含有泥沙、CaCl2、MgCl2、Na2SO4杂质,在粗盐提纯过程中,通常先将粗盐溶于水,再依次滴加过量的______(填序号),(可选用的试剂:①Na2CO3溶液,②BaCl2溶液,③NaOH 溶液,)待充分反应后过滤,再向滤液中滴加适量的______,然后蒸发溶剂得到精盐。
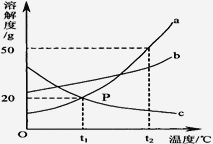
(6)下图是甲、乙、丙三种固体物质的溶解度曲线图.

①要从甲的饱和溶液中析出晶体甲,可采用的方法是_____(只填一种).
②取 t1℃时甲、乙、丙的饱和溶液分别升温至 t2℃,三者所得溶液中溶质的质量分数大小关系为_______(用“>”、“<”或“=”表示)
③分别将t2℃时甲、乙、丙的饱和溶液降温至t1℃,则所得的三种溶液中溶质的质量分数大小关系是________。
【答案】C6H12O6 :CO; H2O2; Ca(OH)2; NaHCO3; 2CO32-; 5 Fe+2HCl==FeCl2+H2↑ 4HNO3![]() NO2+2H2O+O2↑ CuCl2、Na2CO3 ②①③ 稀盐酸 降温结晶法 乙>甲>丙 乙>甲>丙
NO2+2H2O+O2↑ CuCl2、Na2CO3 ②①③ 稀盐酸 降温结晶法 乙>甲>丙 乙>甲>丙
【解析】
(1)葡萄糖的化学式为:C6H12O6,故填:C6H12O6;
具有还原性的有毒气体:CO,故填:CO;
常见制氧物质:H2O2,故填:H2O2;
改良酸性土壤的碱:Ca(OH)2,故填:Ca(OH)2;
小苏打主要成分:NaHCO3,故填:NaHCO3;
碳酸根离子:CO32-,故填:2CO32-;
(2)现有铁、氧化铜、稀盐酸、氢氧化钠溶液、硫酸铜溶液五种物质,两两混合能发生的反应有:铁+稀盐酸、铁+硫酸铜溶液、氧化铜+稀盐酸、稀盐酸+氢氧化钠溶液、氢氧化钠溶液+硫酸铜溶液,共5个,故填:5;其中一个反应的方程式:Fe+2HCl==FeCl2+H2↑,故填:Fe+2HCl==FeCl2+H2↑。
(3)已知浓硝酸(HNO3)见光会发生分解反应的化学方程式为:4HNO3![]() 4NO2+2H2O+O2↑,故填:4HNO3
4NO2+2H2O+O2↑,故填:4HNO3![]() NO2+2H2O+O2↑。
NO2+2H2O+O2↑。
(4)CaCl2样品溶于适量水中,得到澄清的无色溶液可知样品中无CuCl2(溶于水有色)和Na2CO3(与CaCl2不共存)。故填:CuCl2、Na2CO3。
(5)除去CaCl2、MgCl2、Na2SO4分别加入①Na2CO3溶液,③NaOH 溶液,②BaCl2溶液,但加入碳酸钠的作用还有除去过量的BaCl2,故②要在①前,故填:②①③。过量的氢氧化钠和碳酸钠可以用稀盐酸除去,故填:稀盐酸。
(6)①甲物质的溶解度随温度升高而增大,且变化幅度较大,故可用降温结晶法从甲的饱和溶液中析出晶体甲,故填:降温结晶法;
②t1℃时甲、乙、丙的饱和溶液分别升温至 t2℃,甲、乙溶液为不饱和溶液,溶质质量分数乙>甲,丙溶液为过饱和溶液,溶质质量分数最小,三者所得溶液中溶质的质量分数大小关系为乙>甲>丙,故填:乙>甲>丙。
③分别将t2℃时甲、乙、丙的饱和溶液降温至t1℃,甲、乙溶液为饱和溶液,溶质质量分数乙>甲,丙溶液为不饱和溶液,溶质质量分数小于甲,故填:乙>甲>丙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案