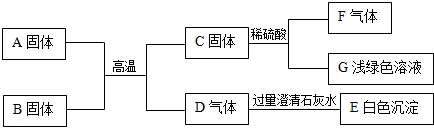
题目内容
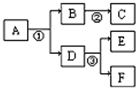 A~F是初中化学常见物质,相互转化关系如下(部分反应物或生成物及反应条件略).
A~F是初中化学常见物质,相互转化关系如下(部分反应物或生成物及反应条件略).(1)若常温下,A为无色有气味的液体,是可再生能源的主要成分,相对分子质量为46,则A的化学式
C2H5OH
C2H5OH
.(2)若常温下,A、B、E、F为常见的无色气体,且A由两元素组成,其质量比为3:1,D为无色液体,C为白色沉淀.C的化学式
CaCO3
CaCO3
,写出①反应的化学方程式CH4+2O2
2H2O+CO2
| ||
CH4+2O2
2H2O+CO2
.
| ||
(3)若A和F中含有相同的金属元素,A中两元素的质量比为7:3,E是一种红色金属,E的化学式
Cu
Cu
,写出③中发生反应的化学方程式Fe+CuSO4═Cu+FeSO4
Fe+CuSO4═Cu+FeSO4
.(4)若A常温下为无色液体,加入二氧化锰时能发生分解反应,该反应的化学方程式为
2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
;已知二氧化锰在特定环境中加热,可转化为四氧化三锰并生成一种气态单质,写出该反应的化学方程式
| ||
3MnO2
Mn3O4+O2↑
| ||
| 加热 |
3MnO2
Mn3O4+O2↑
.
| ||
| 加热 |
分析:(1)根据常温下,A为无色有气味的液体,是可再生能源的主要成分,相对分子质量为46,可以判断A为酒精,可以据此解答;
(2)根据常温下,A、B、E、F为常见的无色气体,且A由两元素组成,其质量比为3:1,可以知道A为甲烷,B和D分别为二氧化碳和水,所以可以判断B为二氧化碳,而D为水,C为白色沉淀,根据图中信息可以判断C可以为碳酸钙沉淀,而E和F分别为氢气和氧气,可以据此解答;
(3)根据A和F中含有相同的金属元素,A中两元素的质量比为7:3,可以判断A为氧化铁,而E是一种红色金属,所以可以判断E为铜单质,那么F可以是硫酸亚铁,所以可以判断D为铁,所以B为水;据此完成解答;
(4)若A常温下为无色液体,加入二氧化锰时能发生分解反应,可以知道A为双氧水,根据题给的信息和质量守恒定律可以写出二氧化锰转化为四氧化三锰的化学方程式.
(2)根据常温下,A、B、E、F为常见的无色气体,且A由两元素组成,其质量比为3:1,可以知道A为甲烷,B和D分别为二氧化碳和水,所以可以判断B为二氧化碳,而D为水,C为白色沉淀,根据图中信息可以判断C可以为碳酸钙沉淀,而E和F分别为氢气和氧气,可以据此解答;
(3)根据A和F中含有相同的金属元素,A中两元素的质量比为7:3,可以判断A为氧化铁,而E是一种红色金属,所以可以判断E为铜单质,那么F可以是硫酸亚铁,所以可以判断D为铁,所以B为水;据此完成解答;
(4)若A常温下为无色液体,加入二氧化锰时能发生分解反应,可以知道A为双氧水,根据题给的信息和质量守恒定律可以写出二氧化锰转化为四氧化三锰的化学方程式.
解答:解:(1)根据常温下,A为无色有气味的液体,是可再生能源的主要成分,相对分子质量为46,可以判断A为酒精,其化学式为:C2H5OH;
(2)根据常温下,A、B、E、F为常见的无色气体,且A由两元素组成,其质量比为3:1,可以知道A为甲烷,B和D分别为二氧化碳和水,所以可以判断B为二氧化碳,而D为水,C为白色沉淀,根据图中信息可以判断C可以为碳酸钙沉淀,其化学式为CaCO3,水可以在通电的条件下反应生成氧气和氢气,所以E和F分别为氢气和氧气,所以反应①为甲烷燃烧的反应,其化学方程式为:CH4+2O2
2H2O+CO2;
(3)根据A和F中含有相同的金属元素,A中两元素的质量比为7:3,可以判断A为氧化铁,而E是一种红色金属,所以可以判断E为铜单质,那么F可以是硫酸亚铁,所以可以判断D为铁,所以B为水,即反应③为铁和硫酸铜的反应,其化学方程式为:Fe+CuSO4═Cu+FeSO4;
(4)若A常温下为无色液体,加入二氧化锰时能发生分解反应,可以知道A为双氧水,该反应的化学方程式为:2H2O2
2H2O+O2↑;根据题意及质量守恒定律可以知道:二氧化锰在特定环境中加热,可转化为四氧化三锰并生成一种气态单质,该气体单质为氧气,所以其反应的化学方程式为:3MnO2
Mn3O4+O2↑.
故答案为:(1)C2H5OH;
(2)CaCO3;CH4+2O2
2H2O+CO2;
(3)Cu;Fe+CuSO4═Cu+FeSO4;
(4)2H2O2
2H2O+O2↑;3MnO2
Mn3O4+O2↑.
(2)根据常温下,A、B、E、F为常见的无色气体,且A由两元素组成,其质量比为3:1,可以知道A为甲烷,B和D分别为二氧化碳和水,所以可以判断B为二氧化碳,而D为水,C为白色沉淀,根据图中信息可以判断C可以为碳酸钙沉淀,其化学式为CaCO3,水可以在通电的条件下反应生成氧气和氢气,所以E和F分别为氢气和氧气,所以反应①为甲烷燃烧的反应,其化学方程式为:CH4+2O2
| ||
(3)根据A和F中含有相同的金属元素,A中两元素的质量比为7:3,可以判断A为氧化铁,而E是一种红色金属,所以可以判断E为铜单质,那么F可以是硫酸亚铁,所以可以判断D为铁,所以B为水,即反应③为铁和硫酸铜的反应,其化学方程式为:Fe+CuSO4═Cu+FeSO4;
(4)若A常温下为无色液体,加入二氧化锰时能发生分解反应,可以知道A为双氧水,该反应的化学方程式为:2H2O2
| ||
| ||
| 加热 |
故答案为:(1)C2H5OH;
(2)CaCO3;CH4+2O2
| ||
(3)Cu;Fe+CuSO4═Cu+FeSO4;
(4)2H2O2
| ||
| ||
| 加热 |
点评:解答好推断题,应熟练掌握以下几方面:①常见物质的性质,②常见物质的反应规律,③某些化学反应的特殊现象.解题的关键是在审题的基础上找准解题的突破口,经过分析,归纳,推理,得出正确的答案.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 30、A~F是初中化学常见物质.
30、A~F是初中化学常见物质. A~F是初中化学常见的6种物质,它们在一定条
A~F是初中化学常见的6种物质,它们在一定条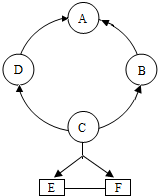 (2012?南昌)如图所示A~F是初中化学常见的物质.图中“→”表示转化关系,“→”表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸.
(2012?南昌)如图所示A~F是初中化学常见的物质.图中“→”表示转化关系,“→”表示相互能反应(部分物质和反应条件未标出).其中A是紫红色金属,B常温下是气体,C是人体胃液中含有的酸. A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答:
A~F是初中化学常见物质,A、B、C、D和CaCO3均含有同一种元素,其中B常用于改良酸性土壤,胃液中含有F.它们之间的转化关系如图所示,“→”表示相互转化.请回答: