题目内容
【题目】某兴趣小组的同学探究浓硫酸与铁定(碳素钢)反应后产生气体的成分. 【查阅资料】①Fe与浓H2SO4反应,加热,有SO2生成
②C与浓H2SO4反应,加热,有CO2和SO2生成
③SO2可使澄清石灰水变浑浊
④SO2可使品红溶液的红色褪去,而CO2不能
⑤SO2可与酸性KMnO4溶液反应使其褪色,而CO2不能
⑥碱石灰的主要成分为NaOH和Cao
【实验探究】
(1)称取24.0g铁钉放入60.0mL浓硫酸中,加热,充分反应后得到的溶液X并收集到气体Y.甲同学通过实验测定并推知气体Y中SO2气体的体积分数为66.7%.同学们认为气体Y中还可能还有H2和Z气体,则Z气体可能是 . 探究实验的主要装置如图所示: 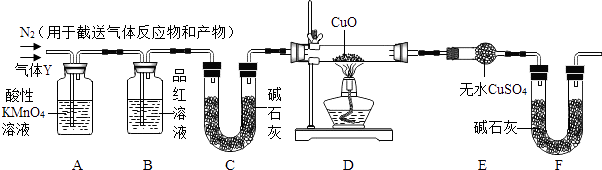
(2)装置A中试剂的作用是 . 
(3)为确认Z的存在,需要将装置甲(如图所示)接入上述装置的(填编号)之间.装置甲中的液体名称是 .
(4)实验中,如果观察到装置D中 , 且装置E中 , 则可确认Y中还有H2气体.
(5)如果需要测定限定体积气体Y中H2的含量(H2约为0.01g).除可用测量H2体积方法外,(选填:“能”或“不能”)用称量上图中装置D、装置E的质量变化的方法,通过计算说明你判断的理由.
【答案】
(1)CO2
(2)除去SO2
(3)BC;澄清石灰水
(4)黑色固体出现红色;白色固体出现蓝色
(5)能
【解析】解:(1)C与浓H2SO4在加热时加热会生成CO2 , 铁钉中含有碳元素,所以,所以答案是:CO2;(2)高锰酸钾具有强氧化性,会与二氧化硫反应,不会与二氧化碳反应,二氧化硫会对二氧化碳的检验产生干扰,所以答案是:除去SO2;(3)检验二氧化碳需要用石灰水检验,C中的碱石灰是为了除去二氧化碳,所以答案是:B C;澄清石灰水;(4)氢气具有还原性会将黑色的氧化铜还原成红色的铜,生成的水会使无水硫酸铜变蓝色,所以答案是:黑色固体出现红色;白色固体出现蓝色;(5)根据题中的叙述列出方程式,然后根据比例式求解水的质量,然后根据题中的数据比较解答. 能(或不能)
解:设0.01g的H2与D中的CuO充分反应后可生成的水的质量为x
H2+CuO | H2O |
2 | 18 |
0.01g | x |
![]() =
= ![]()
x=0.09g
由生成的水的质量可知:
水中含有的氧元素质量为0.09g﹣0.01g=0.08g,则参加反应的CuO中氧元素的质量为0.08g;
反应前后,装置D中的质量变化为参加反应的CuO中氧元素的质量,装置E的质量变化为生成水的质量,装置D、装置E的质量变化分别为0.08g和0.09g.
能.可用电子天平称量出装置D或装置E的差量.
(或不能,因为实验室中托盘天平只能称准0.1g.)

 备战中考寒假系列答案
备战中考寒假系列答案【题目】要学会从化学的视角认识世界。对下列事实的解释错误的是
事 实 | 解 释 | |
A | 在公共场所吸烟导致周围的人被动吸烟 | 分子不断地运动 |
B | 水蒸发为水蒸气 | 分子大小发生改变 |
C | 氢气和液氢都可做燃料 | 相同物质的分子,其化学性质相同 |
D | 100mL水和100mL酒精混合后小于200mL | 分子之间有间隔 |