题目内容
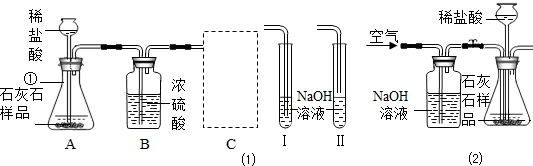
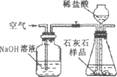
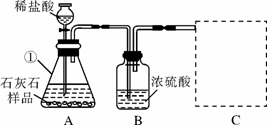
某石灰厂需要测定石灰石样品中CaC03的质量分数.小刚设计了如图所示装置来完成实验(杂质不与酸反应):
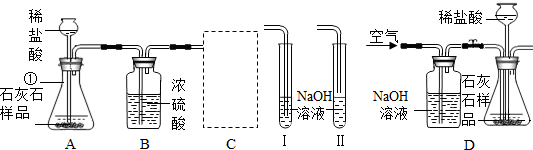
(1)写出下列仪器的名称①
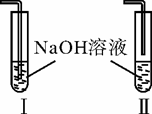
(2)c装置应当选择I、Ⅱ中的
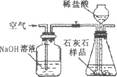
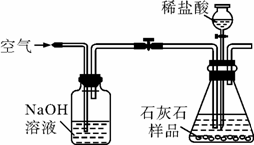
(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应前、后通入空气,其目的是
(4)取用4g石灰石样品,把20g稀盐酸分四次加入石灰石样品中(样品中除碳酸钙外,其余物质既不与酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,最终实验数据如下表:
求①该石灰石样品中碳酸钙的质量分数;
②该盐酸中溶质的质量分数.

(1)写出下列仪器的名称①
锥形瓶
锥形瓶
.(2)c装置应当选择I、Ⅱ中的
Ⅰ
Ⅰ
(填“I”或“Ⅱ”),其作用是充分吸收生成的CO2
充分吸收生成的CO2
.(3)小华提出,要使测定结果更准确,应把A装置改成右图所示装置,并在反应前、后通入空气,其目的是
排除空气中CO2的干扰;使生成的CO2能被充分吸收
排除空气中CO2的干扰;使生成的CO2能被充分吸收
.(4)取用4g石灰石样品,把20g稀盐酸分四次加入石灰石样品中(样品中除碳酸钙外,其余物质既不与酸反应,也不溶于水),充分反应后经过过滤、干燥等操作,最后称量,最终实验数据如下表:
| 稀盐酸的用量 | 第一次加入5g | 第二次加入5g | 第三次加入5g | 第四次加入5g |
| 剩余固体的质量 | 3 | 2 | 1 | 1 |
②该盐酸中溶质的质量分数.
分析:(1)根据常见仪器的名称和用途回答;
(2)根据吸收二氧化碳应当伸入液面以下,这样可以充分吸收二氧化碳及氢氧化钠溶液的性质进行解答;
(3)根据实验目的及空气中有二氧化碳进行解答;
(4)①由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水,因此第三次、第四次实验所剩余的固体即不发生反应也不溶于水的杂质固体的质量;
②根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,然后计算该稀盐酸的质量分数.
(2)根据吸收二氧化碳应当伸入液面以下,这样可以充分吸收二氧化碳及氢氧化钠溶液的性质进行解答;
(3)根据实验目的及空气中有二氧化碳进行解答;
(4)①由于样品中除碳酸钙外,其余的成分既不与盐酸反应,也不溶于水,因此第三次、第四次实验所剩余的固体即不发生反应也不溶于水的杂质固体的质量;
②根据反应的化学方程式,由参加反应的碳酸钙的质量计算盐酸完全反应时消耗的HCl的质量,然后计算该稀盐酸的质量分数.
解答:解:(1)仪器①的名称是:锥形瓶;
(2)氢氧化钠溶液与二氧化碳可以反应,该实验中是用来吸收二氧化碳,吸收二氧化碳导管应当伸入液面以下,这样可以充分吸收二氧化碳,故选Ⅰ装置;
(3)空气中有二氧化碳,在反应前、后通入空气,其目的是:排除空气中二氧化碳的干扰;使生成的二氧化碳能被充分吸收;
故答案为:
(1)锥形瓶;
(2)I;充分吸收生成的CO2
(3)排除空气中CO2的干扰;使生成的CO2能被充分吸收;
(4)①每加入5g稀盐酸可反应1g碳酸钙,而第四次加入稀盐酸所剩余固体质量却没减少,说明碳酸钙已完全反应,剩余固体为杂质;则
石灰石样品中碳酸钙的质量分数=
×100%=75%
②设该盐酸中溶质的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
1g x
=
x=0.73g
盐酸中溶质的质量分数是:
×100%=14.6%
答:该石灰石样品中碳酸钙的质量分数为75%;该盐酸中溶质的质量分数为14.6%.
(2)氢氧化钠溶液与二氧化碳可以反应,该实验中是用来吸收二氧化碳,吸收二氧化碳导管应当伸入液面以下,这样可以充分吸收二氧化碳,故选Ⅰ装置;
(3)空气中有二氧化碳,在反应前、后通入空气,其目的是:排除空气中二氧化碳的干扰;使生成的二氧化碳能被充分吸收;
故答案为:
(1)锥形瓶;
(2)I;充分吸收生成的CO2
(3)排除空气中CO2的干扰;使生成的CO2能被充分吸收;
(4)①每加入5g稀盐酸可反应1g碳酸钙,而第四次加入稀盐酸所剩余固体质量却没减少,说明碳酸钙已完全反应,剩余固体为杂质;则
石灰石样品中碳酸钙的质量分数=
| 4g-1g |
| 4g |
②设该盐酸中溶质的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
1g x
| 100 |
| 1g |
| 73 |
| x |
x=0.73g
盐酸中溶质的质量分数是:
| 0.73g |
| 5g |
答:该石灰石样品中碳酸钙的质量分数为75%;该盐酸中溶质的质量分数为14.6%.
点评:本题考查知识综合而全面,解题时首先要分析探究过程中各装置的作用,理清探究思路,并根据探究思路逐步进行分析,才能找出解决问题的方法;此外,要根据题目所给数据,仔细分析,才能进行正确的解答.

练习册系列答案
相关题目