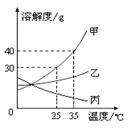
题目内容
“物质的组成与结构决定物质的性质,性质决定用途”是化学学科中重要的观念。酸溶液具有一些共同的化学性质,是因为酸溶液中都含有 ;碱溶液也具有一些共同的化学性质是因为碱溶液中都含有 。因此,酸溶液与碱溶液反应一定能生成 ;氢氧化铝用作中和胃酸过多的药物,其反应方程式为 ,该反应属于基本反应类型中的 反应。
H+ OH— H2O Al(OH)3+3HCl 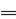 AlCl3 + 3H2O 复分解
AlCl3 + 3H2O 复分解
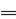 AlCl3 + 3H2O 复分解
AlCl3 + 3H2O 复分解试题分析:由于酸在溶液中电离产生的所有阳离子都是氢离子,即阳离子相同,故酸溶液具有一些共同的化学性质;
由于碱在溶液中电离产生的所有阴离子都是氢氧根离子,即阴离子相同,故碱溶液也具有一些共同的化学性质;
酸与碱之所以能发生中和反应,是因为氢离子和氢氧根离子结合生成了难电离的水,故酸碱中和一定生成水;所以氢氧化铝和胃酸(盐酸)反应,生成氯化铝和水,故反应的化学方程式为Al(OH)3+3HCl=AlCl3+3H2O,由于该反应是两种化合物交换成分,生成了另外两种化合物,故属于复分解反应。
点评:熟练掌握酸碱盐的概念,化学基本反应类型的判定等知识是解答本题的关键,故要求学生在平时的学习中要注重基础知识的学习与积累。

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目