题目内容
【题目】为了解甲酸的分解产物,实验小组进行了以下探究:
【查阅资料】甲酸(HCOOH)的熔点为8.6℃,能分解生成两种物质。
【提出猜想】 实验小组对甲酸的分解产物提出了猜想:
猜想1. H2和CO2; 猜想2. CO和H2O。
【设计实验】20℃时,甲酸的状态为______;从图一装置中选择合适的装置______(填序号)对甲酸进行加热。为了加快分解速率,实验小组加入了催化剂,反应后将分解产物通入图二装置进行实验。
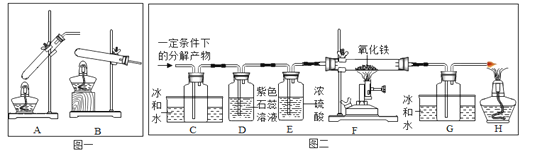
【实验预测】若猜想l成立,则D中的实验现象应为___________________________,所发生反应的化学方程式为__________________________________。
【进行实验】实验中观察到C处瓶内出现大量水珠,F处玻璃管中出现的现象为_____________,所发生反应的化学方程式为__________________________________。甲酸分解的化学方程式为___________________________________。
【交流拓展】资料表明,不同条件下,甲酸的分解产物不同,猜想1和猜想2均能成立。据此小新对甲酸的分解产物又提出新猜想:猜想3. H2O和CO2;猜想4.CO和H2。经讨论认为无需进行实验就能确定猜想3和猜想4都错误,理由是_________________________________________。
【答案】 液态_ B 紫色溶液变红色_ __CO2+H2O==H2CO3 红色粉末变黑色 Fe2O3+3CO===2Fe+3CO_ HCOOH![]() CO↑+H2O↑ 不符合质量守恒定律等(反应前后原子数目不相等)
CO↑+H2O↑ 不符合质量守恒定律等(反应前后原子数目不相等)
【解析】【设计实验】甲酸(HCOOH)的熔点为8.6℃,20℃时,甲酸的状态为液态;给试管中固体加热时,为防止冷凝水倒流入试管,试管口应略微向下倾斜,故从图一装置中选择合适的装置B;【实验预测】若猜想1成立,说明有二氧化碳生成,则D中的实验现象应为紫色石蕊试液变红,发生反应的化学方程式为: ![]() ;【进行实验】实验中观察到C处瓶内出现大量水珠,说明有水和一氧化碳生成,一氧化碳和氧化铁反应,生成铁和二氧化碳,F处玻璃管中出现的现象为:
;【进行实验】实验中观察到C处瓶内出现大量水珠,说明有水和一氧化碳生成,一氧化碳和氧化铁反应,生成铁和二氧化碳,F处玻璃管中出现的现象为: ![]()
![]()
![]()
;红色固体变为黑色;甲酸分解的化学方程式为:HCOOH![]() CO↑+H2O↑;【交流拓展】小新对甲酸的分解产物又提出新猜想:猜想3、H2O和CO2;猜想4、CO和H2。经讨论认为无需进行实验就能确定猜想3和猜想4都错误,理由是反应前后原子个数发生改变。
CO↑+H2O↑;【交流拓展】小新对甲酸的分解产物又提出新猜想:猜想3、H2O和CO2;猜想4、CO和H2。经讨论认为无需进行实验就能确定猜想3和猜想4都错误,理由是反应前后原子个数发生改变。

