题目内容
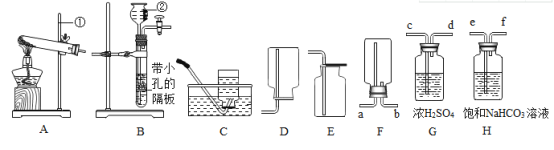
【题目】根据如图实验装置图,按要求回答有关问题:

(1)写出图中带有标号仪器的名称:a_____;b_____;
(2)在实验室中用氯酸钾和二氧化锰混合制取氧气时,发生反应的化学方程式为_____,该反应基本类型为_____;
(3)实验室制取二氧化碳应选择的发生装置是_____(填装置字),选择此装置的理由是_____、_____;收集装置可选择_____(填装置字母),选择此装置的理由是二氧化碳_____、_____,验满此气体的方法是_____。
【答案】试管 长颈漏斗 2KClO3![]() 2KCl+3O2
2KCl+3O2![]() 分解反应 B 反应物是固体和液体 不需加热 E 密度比空气大 能溶于水 将燃烧的木条放在集气瓶口,熄灭则满
分解反应 B 反应物是固体和液体 不需加热 E 密度比空气大 能溶于水 将燃烧的木条放在集气瓶口,熄灭则满
【解析】
(1)a为试管;b为长颈漏斗;
(2)实验室中用氯酸钾和二氧化锰混合制取氧气时,发生反应的化学方程式为:2KClO3![]() 2KCl+3O2
2KCl+3O2![]() ,该反应符合“一变多”的特征,因此属于分解反应;
,该反应符合“一变多”的特征,因此属于分解反应;
(3)实验室一般用石灰石或大理石与稀盐酸在常温下反应制取二氧化碳,因此发生装置选择B;产生的二氧化碳密度比空气大,能溶于水,因此用向上排空气法收集,即选择E装置;检验是否收集满,可将燃着的木条置于瓶口,若熄灭则收集满。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案【题目】某科学探究小组的同学取来一小块生铁(表面有铝粉涂层)片,用砂纸打磨除净涂层。为测定此样品中铁的质量分数,他们将样品放入烧杯中,再加入“足量”的稀盐酸,称量数据见下表:
除净涂层后的生铁样品质量 /g | 12 |
烧杯的质量 /g | 32.5 |
加入稀盐酸的质量 /g | 200 |
反应后烧杯及所盛物质的总质量 /g | 244.1 |
请回答下列问题:
(1)在实验中如何确保所加入的稀盐酸为“足量”?_____。
(2)计算该生铁样品中铁的质量分数_____(写出计算步骤,计算结果精确到0.1%)。
(3)按以上测定方法,则以下操作中会使该样品中铁的质量分数测定值偏小的是_____。
A 加入的稀盐酸不足量
B 换用溶质质量分数更高的盐酸进行实验
C 未将样品表面涂层(已完全氧化)打磨干净
D 将表面涂层打磨干净的生铁样品磨成粉末