题目内容
(1)现有含杂质25%的大理石20g(杂质不与盐酸反应)恰好与150g稀盐酸完全反应.求:
①产生二氧化碳多少克?
②稀盐酸中溶质的质量分数为多少?
(2)质量相同的Na2CO3和CaCO3分别与足量稀盐酸反应,产生二氧化碳的质量比为______.
【答案】分析:(1)利用石灰石的相关信息描述可求反应的碳酸钙的质量,根据碳酸钙与石灰石的反应方程式可求参加反应的氯化氢的质量,因两者恰好反应,所以可知该氯化氢的质量即是100g盐酸中溶质的质量,据此计算盐酸的溶质质量分数即可.
(2)假设一定质量的两种物质与盐酸反应,利用方程式的计算解决即可;
解答:解:(1)含杂质25%的大理石20g中含有的碳酸钙质量是20g×(1-25%)=15g
设产生二氧化碳的质量为x,盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
15g y x
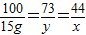
x=6.6g y=10.95g
故稀盐酸中溶质的质量分数为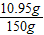 ×100%=7.3%
×100%=7.3%
(2)假设两物质质量均为mg,设mgCaCO3反应放出二氧化碳质量为x,mgNa2CO3反应放出二氧化碳质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
mg x
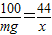
解之得 x=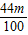 g
g
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
mg y
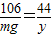
解之得 y=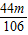 g,
g,
则质量相同的Na2CO3和CaCO3分别与足量稀盐酸反应,产生二氧化碳的质量比为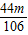 :
: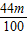 =50:53;
=50:53;
故答案为:(1)①产生二氧化碳6.6克;②稀盐酸中溶质的质量分数为7.3%;(2)50:53;
点评:本题主要考查有关含杂质物质的化学方程式计算和溶质质量分数的计算,解题的关键是找到反应中的已知量进而求出未知量,然后根据要求计算解决即可.
(2)假设一定质量的两种物质与盐酸反应,利用方程式的计算解决即可;
解答:解:(1)含杂质25%的大理石20g中含有的碳酸钙质量是20g×(1-25%)=15g
设产生二氧化碳的质量为x,盐酸中HCl的质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
15g y x
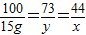
x=6.6g y=10.95g
故稀盐酸中溶质的质量分数为
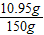 ×100%=7.3%
×100%=7.3%(2)假设两物质质量均为mg,设mgCaCO3反应放出二氧化碳质量为x,mgNa2CO3反应放出二氧化碳质量为y
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
mg x
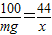
解之得 x=
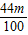 g
gNa2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
mg y
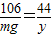
解之得 y=
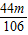 g,
g,则质量相同的Na2CO3和CaCO3分别与足量稀盐酸反应,产生二氧化碳的质量比为
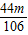 :
: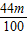 =50:53;
=50:53;故答案为:(1)①产生二氧化碳6.6克;②稀盐酸中溶质的质量分数为7.3%;(2)50:53;
点评:本题主要考查有关含杂质物质的化学方程式计算和溶质质量分数的计算,解题的关键是找到反应中的已知量进而求出未知量,然后根据要求计算解决即可.

练习册系列答案
相关题目