题目内容
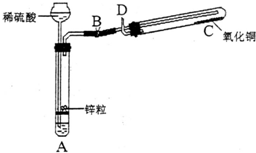 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:(1)实验时,打开B处止水夹,在试管A中,除了液面上升以外,用眼睛还可以观察到的现象是
有气泡冒出
有气泡冒出
,过一段时间后,用手触摸试管A的外壁可以感觉到的现象是发热
发热
,试管A中发生反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑
Zn+H2SO4═ZnSO4+H2↑
,其反应类型为置换反应
置换反应
.(2)在做氢气还原氧化铜实验之前,必须在D出口处
检验氢气的纯度
检验氢气的纯度
,然后在C
C
处点燃酒精灯加热;实验过程中,在试管C中可以观察到的现象是黑色氧化铜变为红色,有无色液体生成
黑色氧化铜变为红色,有无色液体生成
;发生反应的化学方程式为H2+CuO
Cu+H2O
| ||
H2+CuO
Cu+H2O
;实验结束时,
| ||
后
后
关闭B处止水夹,先
先
停止加热(填“先”或“后”).(3)实验过程中,该同学若想证明氢气具有可燃性,其实验操作是
点燃出口D处的氢气
点燃出口D处的氢气
.分析:(1)根据锌粒和稀硫酸反应的现象、反应原理、反应特点进行解答;
(2)根据氢气还原氧化铜的操作步骤和注意事项及反应原理分析解答;
(3)根据装置特点进行分析.
(2)根据氢气还原氧化铜的操作步骤和注意事项及反应原理分析解答;
(3)根据装置特点进行分析.
解答:解:(1)锌粒和稀硫酸反应生成硫酸锌和氢气,放出热量,方程式是Zn+H2SO4═ZnSO4+H2↑,该反应由一种单质和一种化合物生成另一种单质和化合物,属于置换反应;
故答案为:有气泡冒出; 发热; Zn+H2SO4═ZnSO4+H2↑ 置换反应;
(2)氢气具有可燃性,与空气混合可能发生爆炸,所以实验前要检验气体的纯度,氢气还原氧化铜的实验步骤可简单概括为“氢气早出晚归,酒精灯迟到早退”,所以验纯后点燃酒精灯加热有药品的部位,氢气具有还原性,可夺取氧化铜里的氧元素生成水,所以试管内黑色的氧化铜会变为红色,同时有无色液体生成,反应的方程式是H2+CuO
Cu+H2O,实验完毕,先停止加热,继续通氢气至试管冷却,防止生成的铜重新被氧化;
故答案为:检验氢气纯度; C; 黑色氧化铜变为红色,有无色液体生成; H2+CuO
Cu+H2O; 后;先;
(3)要证明氢气的可燃性,可在出口D处点燃;
故答案为:点燃出口D处的氢气.
故答案为:有气泡冒出; 发热; Zn+H2SO4═ZnSO4+H2↑ 置换反应;
(2)氢气具有可燃性,与空气混合可能发生爆炸,所以实验前要检验气体的纯度,氢气还原氧化铜的实验步骤可简单概括为“氢气早出晚归,酒精灯迟到早退”,所以验纯后点燃酒精灯加热有药品的部位,氢气具有还原性,可夺取氧化铜里的氧元素生成水,所以试管内黑色的氧化铜会变为红色,同时有无色液体生成,反应的方程式是H2+CuO
| ||
故答案为:检验氢气纯度; C; 黑色氧化铜变为红色,有无色液体生成; H2+CuO
| ||
(3)要证明氢气的可燃性,可在出口D处点燃;
故答案为:点燃出口D处的氢气.
点评:本题对氢气的制取和性质进行了细致的考查,解题时要根据相关知识并结合实验装置细心分析,才能正确解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目


 某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白:
某学生用如图所示装置制备氢气,并用制得的氢气还原氧化铜(装置中必要的铁架台、铁夹、加热设备等在图中均已略去).请填写下列空白: